
| A. | 元素周期表的七个周期永远不会改变 | |
| B. | 元素周期表有九个横行,分为七个周期 | |
| C. | 元素周期表有十八个纵行,分为十六个族 | |
| D. | 元素周期表有十八个纵行,分为十八个族 |
科目:高中化学 来源: 题型:解答题
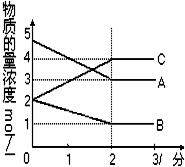 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示 2C.
2C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,碳为负极 | |
| B. | Zn为负极,碳极发生氧化反应 | |
| C. | 工作时,电子由碳极经过电路流向Zn极 | |
| D. | 长时间连续使用时,内装糊状物可能流出腐蚀用电器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C的化学式为Mg(OH)2
,C的化学式为Mg(OH)2查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com