
| A. | 原子半径:Cl>Na>O>N | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 熔点:CBr4>CCl4>CF4 | D. | 热稳定性:HF>HCl>H2S>H2O |
分析 A.电子层越多,原子半径越大,同周期从左向右原子半径减小;
B.金属性越强,对应碱的碱性越强;
C.相对分子质量越大的分子,熔点越大;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径为Na>Cl>N>O,故A错误;
B.金属性越强,对应碱的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故B错误;
C.相对分子质量越大的分子,熔点越大,则熔点:CBr4>CCl4>CF4,故C正确;
D.非金属性越强,对应氢化物越稳定,则热稳定性:HF>H2O>HCl>H2S,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀Ph | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
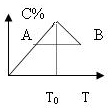 对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:
对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 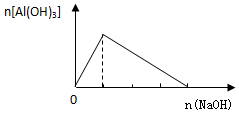 向AlCl3溶液中逐滴加入NaOH溶液 | |
| B. | 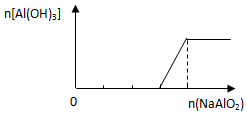 向稀盐酸中逐滴加入NaAlO2溶液 | |
| C. | 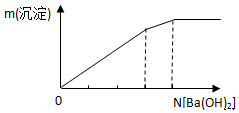 向明矾溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 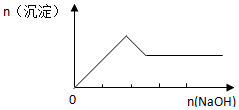 向Al2O3和Fe2O3的混合物中加入过量稀盐酸,向所得溶液中滴加NaOH的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| B. | 在pOH=2的溶液中:NH4+、Na+、SO42-、AlO2- | |
| C. | 在pH=1的溶液中:K+、Ag+、Mg2+、Fe2+ | |
| D. | 水电离出来的c(H+)=1×10-13 mol•L-1的溶液:K+、HCO3-、Br-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有部分元素的存在,性质和原子结构如下所述:
现有部分元素的存在,性质和原子结构如下所述:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
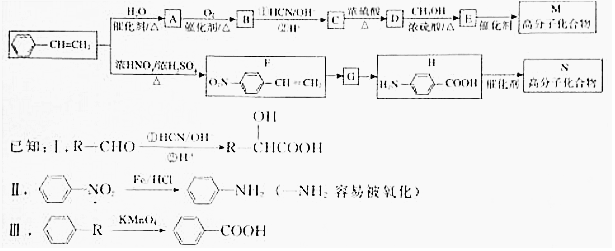
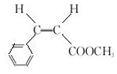 .
. 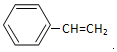 →F的反应类型为取代 反应.
→F的反应类型为取代 反应.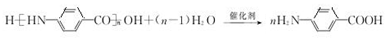 .
.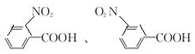 .
.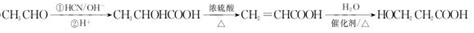 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 纯碱可用于生产普通玻璃,也可用来治疗胃酸过多的病症 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com