
在一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志的是( )
①C的生成速率是B的生成速率的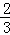 倍
倍
②单位时间生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化
⑥单位时间消耗 a mol A,同时生成3a mol B
⑦A、B、C 的分子数目比为1:3:2.
|
| A. | ②⑦ | B. | ⑥④ | C. | ①③ | D. | ⑤⑥ |
考点:
化学平衡状态的判断.
专题:
化学平衡专题.
分析:
在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变,注意该反应中,反应前后气体的化学计量数之和不相等,压强可作为判断的依据.
解答:
解:①当反应达到平衡状态时,C的生成速率是B的生成速率的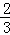 倍,所以能判断是否达到平衡状态,故不选;
倍,所以能判断是否达到平衡状态,故不选;
②无论反应是否达到平衡状态,单位时间生成a mol A,同时生成3a mo1B,所以不能判断是否达到平衡状态,故选;
③当反应达到平衡状态时,各物质的物质的量不变,则A、B、C的浓度不再变化,所以能判断是否达到平衡状态,故不选;
④当反应达到平衡状态时,各物质的物质的量不变,则混合气体的总压强不再变化,所以能判断是否达到平衡状态,故不选;
⑤当反应达到平衡状态时,混合气体的物质的量不再变化,所以能判断是否达到平衡状态,故不选;
⑥当反应达到平衡状态时,单位时间消耗 a mol A,同时生成3amolB,所以能判断是否达到平衡状态,故不选;
⑦无论反应是否达到平衡状态,A、B、C 的分子数目比都可能为1:3:2,这与反应初始量和转化率有关,所以不能判断是否达到平衡状态,故选;
故选A.
点评:
本题考查了化学平衡状态的判断,难度不大,注意反应前后气体体积不变的化学反应不能用压强来判断是否达到平衡状态.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:简答题
选考[化学——物质结构与性质](15分)由Cu、N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态 Cu+的最外层核外电子排布式为_________.
(2)研究者预想合成一个纯粹由氮组成的新物种 N5+N3-,若N5+ 离子中每个氮原子均满足8电子结构,以下有关N5+ 推测正确的是 ( )
A.N5+有24个电子
B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键
(3)化合物 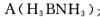 是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物 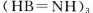 。通过
。通过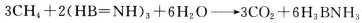 制得。
制得。
①与上述化学方程式有关的叙述不正确的是_________(填标号)。
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个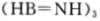 分子中有_________个
分子中有_________个 键。
键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为_________图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
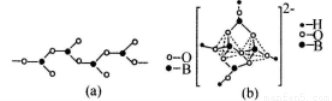
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为_________(用含有a的代数式表示)。在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_________g(氧离子的半径为1. 40×10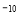 m,
m, 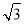 ≈l. 732)。
≈l. 732)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省金华十校高三下学期高考模拟(4月)理综化学试卷(解析版) 题型:选择题
乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
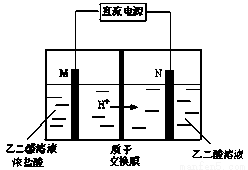
A.N电极上的电极反应式:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O
B.若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol
C.M电极上的电极反应式为:2Cl--2e-=Cl2↑
D.乙二醛与M电极的产物反应生成乙醛酸的化学方程式: Cl2+OHC-CHO+ H2O = HOOC-CHO+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
|
| A. | 分子中的C、H、O的个数比为1:2:3 |
|
| B. | 分子中C、H个数比为1:2 |
|
| C. | 该有机物的相对分子质量为14 |
|
| D. | 该分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质.某课外小组设计了如下装置,证明乙烯中混有CO2、SO2,并回答下列问题:
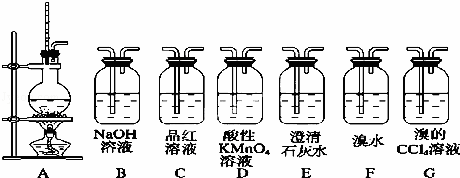
(1)装置A是乙烯的发生装置,图中一处明显的错误是 ,将反应后的混合气体通入到溴水当中,可能发生的化学反应方程式是: 、 ;
(2)若要检验装置A中所得气体含有SO2,可将混合气体直接通入 (填代号,下同)装置;若要检验A中所得气体含有CH2=CH2,可将混合气体先通入 装置,然后通入D装置;
(3)该小组将从装置A出来的混合气体依次通过B、E、F,发现石灰水中无明显变化,则F中出现的现象为 ;
(4)若要将三种气体全部检验出来,且要求所用的试剂瓶最少,则气体从A出来依次通过的装置先后顺序是(假设试剂足量) .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中的微粒浓度关系正确的是( )
|
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣) |
|
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3) |
|
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+) |
|
| D. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)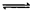 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;
(2)该反应为 反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为 ℃;
(4)830℃时,向该容器中加入1L CO2与1L H2,平衡时CO2的体积分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是()
A. 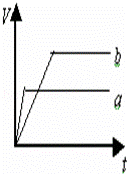 B.
B. 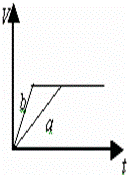 C.
C. 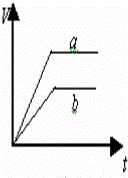 D.
D. 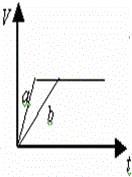
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于纯净物、混合物、强电解质、弱电解质的正确组合是()
纯净物 混合物 强电解质 弱电解质 非电解质
A 纯盐酸 水煤气 硫酸 醋酸 干冰
B 冰醋酸 福尔马林 硫酸钡 亚硫酸 二氧化硫
C 油酯 淀粉 苛性钾 氢硫酸 碳酸钙
D 重水 纤维素 氯化钠 次氯酸 氯气
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com