
在室温下,下列叙述正确的是
A.将 的一元酸溶液稀释到 的一元酸溶液稀释到 ,若溶液的 ,若溶液的 ,则此酸为弱酸 ,则此酸为弱酸 |
B.将  盐酸稀释到 盐酸稀释到 ,得到 ,得到 的盐酸 的盐酸 |
C.用 的盐酸分别中和 的盐酸分别中和 溶液和氨水, 溶液和氨水,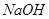 消耗盐酸的体积大 消耗盐酸的体积大 |
D. 的盐酸与 的盐酸与 的硫酸比较, 的硫酸比较, |
A
解析试题分析:A,在强电解质溶液中电解质完全电离,在弱电解质溶液中存在电离平衡,当加水稀释时,电离平衡正向移动,使溶液中H+的浓度又略有增加,因此其pH增大的数值小于强电解质,正确。B.酸溶液无限稀释还是酸性溶液,不可能变为碱性溶液,错误;C.由于弱碱部分电离,所以当NaOH与氨水的pH相等时,一水合氨的浓度大于NaOH的浓度,当用等浓度的HCl来中和时,氨水消耗的盐酸的体积大,错误;D.PH=2的溶液c(H+)=10-2mol/L, c(Cl-)=c(H+)=10-2mol/L, PH=1的硫酸溶液c(H+)=10-1mol/L,c(SO42-)=1/2c(H+)=0.05mol/L,因此c(Cl-)< c(SO42-).
考点:考查溶液中离子浓度的大小比较的知识。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
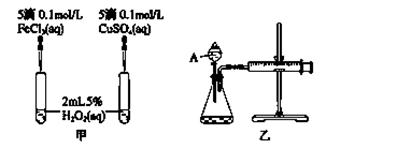
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列表述中,合理的是( )
| A.将水加热,Kw不变,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是
| A.1 mol/L的AlCl3溶液 | B.2mol/L的NaCl溶液 |
| C.1.4mol/L的BaCl2溶液 | D.1mol/L的MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是( )
| A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S) |
| B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+) |
| C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时, 溶液中  的值增大到原来的10倍 的值增大到原来的10倍 |
| D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是
| A.10∶1 | B.1∶10 | C.1∶100 | D.1∶2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是
| A.c(OH-) | B.pH | C.c(NH4+)/c(NH3·H2O) | D.c(H+)·c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
0.lmol/L的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.lmol/L。如果要使c(CO32-)更接近于0.lmol/L,可以采取的措施是( )
| A.加入少量盐酸 | B.加入适量的水 | C.加入适量的KOH | D.加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com