


科目:高中化学 来源: 题型:
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度 g/100gH2O | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称重时发现砝码生锈 |
| B、定容时观察液面俯视 |
| C、有少量NaOH溶液残留在烧杯中 |
| D、容量瓶中原来有少量的蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| B、在含Fe3+的溶液:I-、K+、SCN-、Mg2+ |
| C、与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- |
| D、加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.
化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:


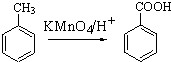 Ⅱ.
Ⅱ.
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na、Cu、Al、O、C、H是常见的六种元素.
Na、Cu、Al、O、C、H是常见的六种元素.| 第一电离能 | 离子半径 | 沸点 |
| Na | O2- | CH4 |
| 物 质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 亚磷酸(H3P03 )是二元酸,H3 P03溶液中存在电离平衡:H3PO3?H-+H2PO3-亚磷酸与足量NaOH溶液反应,生成Na2 HPO3.
亚磷酸(H3P03 )是二元酸,H3 P03溶液中存在电离平衡:H3PO3?H-+H2PO3-亚磷酸与足量NaOH溶液反应,生成Na2 HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com