
| A、1L 0.1 mol?L-1碳酸钠溶液中的阴离子总数为0.1NA |
| B、将400 mL 1 mol/L的HNO3溶液与7 g Fe粉充分反应,转移电子数为0.375NA |
| C、标准状况下,14 g氮气中共用电子对的数目为1.5NA |
| D、已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8KJ/mol中反应物的转化率为30%,相同条件下,当放出91.8 kJ热量时,生成氨分子的数目为0.6NA |
| 7g |
| 56g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
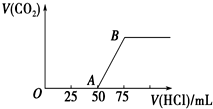 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥⑧ |
| B、②③⑤⑦⑧ |
| C、②③⑤⑥⑦ |
| D、②③④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| O | 2- 4 |
| O | 2- 4 |
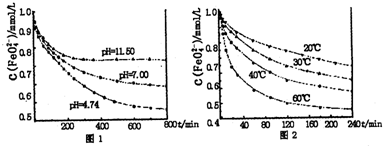
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理性质 | 易溶于水,不溶于乙醇;熔点 48.2℃;在潮湿的空气中易潮解 |
| 化学性质 | 43℃以上的空气中易风化;遇酸易分解 (S2O32-+2H+=S↓+SO2↑+H2O ) |
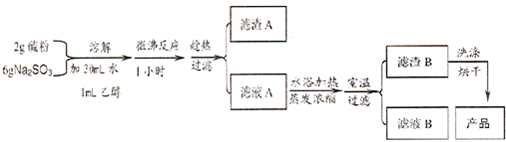
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
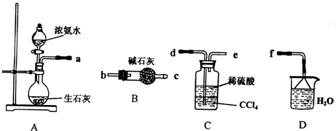
查看答案和解析>>
科目:高中化学 来源: 题型:
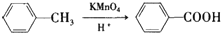
 (苯胺,易被氧化)
(苯胺,易被氧化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com