
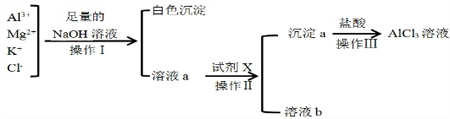
 某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失分析 由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀a为氢氧化铝,溶液b中含KCl、NaCl,以此来解答.
解答 解:由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,过滤得到溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀a为氢氧化铝,溶液b中含KCl、NaCl;
(1)依据分析可知,分离提纯过程中操作(1)的名称为过滤;所用到的玻璃仪器为:烧杯、玻璃棒、漏斗;沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次;
故答案为:过滤;烧杯、玻璃棒、漏斗;沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至浸没沉淀,静置使水全部滤出后,重复操作2--3次;
(2)用氨水,则Mg2+、Al3+均转化为沉淀,不能分离,则不能用氨水代替NaOH;
故答案为:否;因为Al(OH)3不能溶于过量的氨水中,不能将Al(OH)3与Mg(OH)2分开;
(3)Al3+与过量NaOH反应,溶液a中含AlO2-、K+、Cl-、Na+、OH-,溶液a中存在的阴离子AlO2-、Cl-、OH-;向溶液a中加入试剂X的最佳方案是通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝固体,反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-、Cl-、OH-;向a溶液中通入足(过量)的CO2气体;CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(4)钾元素的焰色反应为紫色,故答案为:进行焰色反应,若透过蓝色钴玻璃观察到火焰呈紫色,则证明含有K+.
点评 本题考查混合物分离、提纯实验方案的设计以及离子的检验,为高频考点,把握实验流程中发生的反应为解答的关键,侧重分析与实验能力的考查,注意氢氧化铝的两性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Al2O3可用作耐火材料 | |
| B. | Al(OH3)可用于中和胃酸过多 | |
| C. | Na2O2可用于呼吸面具和潜艇中作氧气的来源 | |
| D. | NaHCO3的水溶液呈碱性,因此NaHCO3不能用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 充电时储氢合金作阳极 | |
| B. | 充电时阳极周围pH增大 | |
| C. | 放电时负极反应:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 放电时每转移6mol电子,有6moLNiO(OH)被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


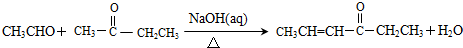
 ,其反应类型是加成反应.
,其反应类型是加成反应.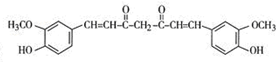 .
.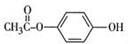 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | Na2S2O3标准液体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 4.20 | 26.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com