
| A、可以用新制氢氧化铜鉴别③与④ |
| B、只有③能与金属钠反应 |
| C、①、②、③均能发生取代反应 |
| D、一定条件下,④可以转化为② |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 溴乙烷(Br2) | NaOH溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | C2H5OH(H2O) | 新制生石灰 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下是无色无味气体 |
| B、在通常状况下,密度比空气小 |
| C、能使酸性KMnO4溶液褪色 |
| D、在一定条件下能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
| B、利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| C、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
| D、神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
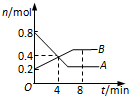 某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )| A、该反应的化学方程式为:2A→B |
| B、反应开始至4 min时,A的平均反应速率为0.05 mol/(L?min) |
| C、4 min时,正、逆反应速率的大小关系为:v(正)>v(逆) |
| D、8 min时,正、逆反应速率的大小关系为:v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究小组探究溴化亚铁水溶液与氯气反应.
某化学研究小组探究溴化亚铁水溶液与氯气反应.| 试验 | 操作 | 现象 |
| a | 取少量FeCl2溶液于试管中,滴加少量氯,再滴加2滴KSCN溶液,振荡静置. | 溶液变为血红色 |
| b | 取少量FeCl3溶液于试管中,滴加少量溴化钠溶液和少量CCl4,振荡静置. | CCl4层没有明显变化 |
| c | |
CCl4层由无色变为橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 高温 |
| 高温高压 |
| 催化剂 |
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol?L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g?L-1) | ρ1 | ρ2 |
| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过1H核磁共振谱图可以区分乙醇和乙酸乙酯 |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有共用电子对数目为1.2NA(设NA为阿伏加德罗常数的值.) |
| C、在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA(设NA为阿伏加德罗常数的值.) |
| D、煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应:Cu2++S2-═CuS↓ |
| C、1mol?L-1的NaAlO2溶液和2.5mol?L-1的盐酸等体积互相均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
| D、Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com