
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 气体35Cl2的摩尔质量为70 | |
| D. | 3.5g的气体35Cl2的体积为2.24L |
分析 A.氯原子质子数为17;
B.1H35Cl分子含有中子数为0+35-17=18,进而计算中子物质的量,再根据N=nNA计算中子数目;
C.摩尔质量的单位为g/mol等;
D.气体的所处温度、压强不确定,密度也未知,不能确定体积.
解答 解:A.35Cl原子所含质子数为17,中子数为35-17=18,故A错误;
B.1H35Cl分子含有中子数为0+35-17=18,$\frac{1}{18}$mol的1H35Cl分子所含中子为1mol,含有中子数约为6.02×1023,故B正确;
C.气体35Cl2的摩尔质量约是70g/mol,相对分子质量约是70,故C错误;
D.3.5g的气体35Cl2的物质的量为0.05mol,由于气体的所处温度、压强不确定,密度也未知,不能确定体积,故D错误,
故选B.
点评 本题考查物质的量有关计算、原子构成、摩尔质量与气体摩尔体积等,比较基础,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
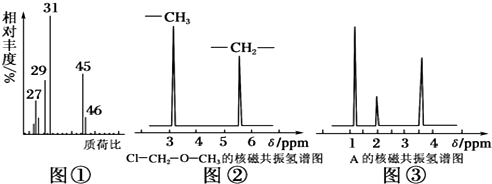
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第3周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 由苯制溴苯;由乙烷与氯气在光照下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在此反应中,每生成1molO2(PtF6),则转移1mol电子 | |
| B. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| C. | O2(PtF6)中氧元素的化合价是+1价 | |
| D. | O2(PtF6)中仅存在离子键不存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属元素只能形成共价化合物 | |
| B. | 在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 离子化合物可能含有共价键原子核之间的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 卤化银的溶解度随核电荷数的增加逐渐增大 | |
| C. | 单质与水反应均可表示为X2+H2O═HX+HXO | |
| D. | 随核电荷数的增加,X-的半径递增,还原性递减 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{WV{N}_{A}}{22.4M}$ | B. | $\frac{MV{N}_{A}}{22.4W}$ | C. | $\frac{WV}{22.4M}$ | D. | $\frac{MV}{22.4W}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com