
【题目】25 ℃时,氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入003 g Zn粉,在相同条件下充分反应,下列有关叙述正确的是
A. 稀释2倍后,两溶液的pH:盐酸小于醋酸
B. 盐酸和醋酸分别与Zn反应放出的氢气一样多
C. 盐酸和醋酸分别与Zn反应的速率一样大
D. 稀释2倍前,醋酸溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
【答案】B
【解析】n(Zn)= ![]() ≈0.00046mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.00046mol×2=0.00092mol,100mL,氢离子浓度都为1×10-2 mol·L-1的盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸略有剩余反应,氢离子浓度都为1×10-2 mol·L-1的醋酸浓度大于盐酸,所以100mL醋酸中醋酸的物质的量大于盐酸,醋酸过量较多。
≈0.00046mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.00046mol×2=0.00092mol,100mL,氢离子浓度都为1×10-2 mol·L-1的盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸略有剩余反应,氢离子浓度都为1×10-2 mol·L-1的醋酸浓度大于盐酸,所以100mL醋酸中醋酸的物质的量大于盐酸,醋酸过量较多。
A.氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,醋酸的浓度大于盐酸,稀释2倍后,醋酸继续电离,稀释后两溶液的pH:盐酸大于醋酸,故A错误;B.醋酸过量、盐酸略有剩余反应,所以生成氢气的量与锌的质量成正比,两种溶液中锌的质量相等,所以放出的氢气一样多,故B正确;C.起始是氢离子浓度相同,反应速率相等,随着反应的进行,醋酸不断电离出氢离子,导致反应过程中醋酸中的氢离子浓度大于盐酸,则醋酸反应速率大于盐酸,故C错误;D.醋酸溶液中存在醋酸的电离和水的电离,根据电荷守恒c(CH3COO-)+ c( OH-)=c(H+),因此c(H+)>c(CH3COO-),故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】图1是部分短周期元素的常见化合价与原子序数的关系图:
(1)元素F在周期表中的位置 .
(2)DH其所含化学键类型为 .
(3)C、D、G对应的简单离子半径大小顺序是 . (用离子符号回答)
(4)某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:①溶液a和溶液b分别为 , .
②溶液c中的离子反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明醋酸是弱电解质,几位同学分别选用下列试剂进行实验:0.10 mol·L-1醋酸溶液、0.10 mol·L-1CH3COONa溶液、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测得0.10 mol·L-1CH3COONa溶液的pH>7,则可以认定醋酸是弱电解质。用化学方程式解释pH>7的原因________________________________________
(2)乙取出10 mL 0.10 mol·L-1醋酸溶液,滴入几滴甲基橙试剂,溶液显红色,然后再加入0.001mol醋酸钠晶体,溶液颜色变为橙色,则可以认定醋酸是弱电解质。则溶液中
①c(Na+)_____c(CH3COOH)(填“>”、“=”或 “<”)
②2c(H+)-2c(OH-) ____c(CH3COO-)-c(CH3COOH)(填“>”、“=”或 “<”)
(3)丙用pH试纸测出0.10 mol·L-1的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?_______。 (填“正确”或“不正确”)
(4)丁取出10 mL 0.10 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1000mL,再用pH试纸测定其pH=b,若醋酸是弱电解质,则a、b应该满足的关系是__________(用“不等式”表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究部分元素氢化物的沸点变化规律的图象,折线c可以表达出第族元素氢化物的沸点变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线﹣﹣折线a和折线b,你认为正确的是(填“a”或“b”),理由是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)写出装置I中主要发生反应的离子方程式_______________________;
装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式______________________。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω(纵坐标)与溶液pH(横坐标)的关系如下图所示:
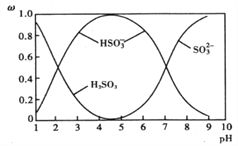
①下列说法不正确的是__________(填标号)
A. 为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
B. pH=7时,溶液中:c(Na+)<c(HSO3-)+c(SO32-)
C. pH=9时,溶液中:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②由图中数据,可以计算出H2SO3的第二级电离平衡常数K2约为_______
(3)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为2,结合化学平衡移动原理用有关的化学用语解释溶液pH降低的原因______________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol·L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生反应的类型和条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1000 mol·L-1NaOH溶液滴定20. 00 mL 0.1000 mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
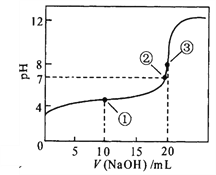
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c( H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)> c( CH3COO-) >c( H+)
D. 滴定过程中会出现:c(CH3COOH)>c( CH3COO-)>c(H+) >c( Na+)>c( OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com