
| A. | ① | B. | ③ | C. | ②③ | D. | ①③ |
分析 ①氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性;
②氯化氢和氢氧化钠都是强电解质,pH=3的盐酸氢离子浓度和pH=11的氢氧化钠溶液中氢氧根离子浓度相等,二者等体积混合恰好反应生成氯化钠,其溶液呈中性;
③一水合氨是弱电解质,氯化氢是强电解质,pH=11的氨水浓度大于pH=3的盐酸,二者等体积混合,溶液呈碱性.
解答 解:①0.001mol•L-1氨水与0.001mol•L-1HCl溶液等体积混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性;
②氯化氢和氢氧化钠都是强电解质,pH=3的盐酸中氢离子浓度为10-3,pH=11的氢氧化钠溶液中氢氧根的浓度为:10-1,两者等体积混合,物质的量不相等,其溶液呈碱性;
③一水合氨是弱电解质,氯化氢是强电解质,pH=11的氨水浓度大于pH=1的盐酸,二者等体积混合,氨水过量导致溶液呈碱性,
故选A.
点评 本题考查了酸碱混合溶液定性判断,根据酸碱的强弱结合二者的物质的量相对大小确定混合溶液的pH,从而得出结论,难度不大.


科目:高中化学 来源: 题型:选择题
| 物质种类 | 厕所清洁剂 | 桔子汁 | 牛奶 | 草木灰水 | 厨房清洁剂 |
| pH | 1 | 3 | 6.5 | 11 | 12.5 |
| A. | 牛奶的酸性比桔子汁强 | |
| B. | 用湿润的pH试纸蘸取厕所清洁剂测其pH | |
| C. | 草木灰水显酸性 | |
| D. | 胃酸过多的人不宜多吃桔子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度和容器压强不变,充入1mol NH3(g) | |
| B. | 保持温度和容器体积不变,充入1mol NH3(g) | |
| C. | 保持温度和容器压强不变,充入1mol N2(g) | |
| D. | 保持温度和容器体积不变,充入1mol H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水久置后pH增大 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 可用澄清石灰水除去CO2中混有的少量SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:NH4++OH-═NH3.H2O | |
| C. | AlCl3溶液中滴加过量氨水:Al3++3NH3.H2O═3NH4++Al(OH)3↓ | |
| D. | 磁性氧化铁(Fe3O4)溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量白磷贮存于水中,切割时要在水下进行 | |
| B. | 液溴直接保存于磨口玻璃塞的细口棕色瓶中 | |
| C. | KOH溶液存放在磨口玻璃塞的广口瓶中 | |
| D. | 少量金属钠存放在无水乙醇中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,18 g水中含有的水分子数目为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
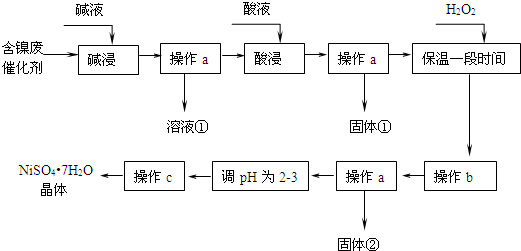
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com