
| A. | 酸性KMnO4溶液中通入SO2气体后紫红色消失 | |
| B. | 滴有酚酞的NaOH溶液中通入SO2气体后红色消失 | |
| C. | 品红溶液中通入SO2气体后红色消失 | |
| D. | 溴水中通入SO2气体后橙色消失 |
分析 A.二氧化硫具有还原性,使酸性KMnO4溶液褪色;
B.SO2是酸性氧化物,能与碱反应;
C.SO2能使品红褪色,具有漂白性;
D.二氧化硫具有还原性,使溴水褪色;
解答 解:A.二氧化硫具有还原性,能被酸性高锰酸钾氧化,使酸性KMnO4溶液褪色,故A错误;
B.SO2是酸性氧化物,与水反应生成亚硫酸,与氢氧化钠溶液反应,故SO2能使滴有酚酞的NaOH溶液中通入SO2气体后红色消失,故B正确;
C.SO2具有漂白性,能使品红溶液褪色,故C错误;
D.二氧化硫具有还原性,能被溴水氧化,使溴水褪色,故D错误,
故选B.
点评 本题考查了二氧化硫的性质,明确二氧化硫的还原性、漂白性、酸性氧化物的性质是解题关键,题目难度不大.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .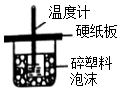 装置用于中和热的测定 | |
| B. | 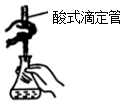 装置用于高锰酸钾溶液滴定草酸 | |
| C. | 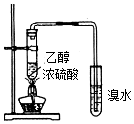 装置用于制取乙烯并验证乙烯的性质 | |
| D. | 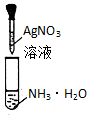 装置用于配制银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Na+、Cl-、K+ | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +nCH3OH$→_{△}^{浓H_{2}SO_{4}}$
+nCH3OH$→_{△}^{浓H_{2}SO_{4}}$ +2nH2O.
+2nH2O. $?_{△}^{催化剂}$
$?_{△}^{催化剂}$ +2nCH3OH.
+2nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ④⑤⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
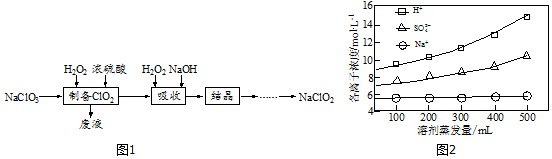
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
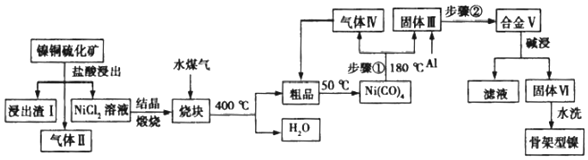
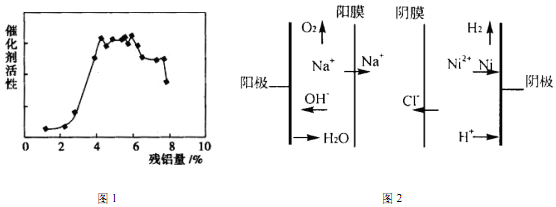
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com