
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol/L,放出热量b kJ,B中C的浓度分别为
mol/L,放出热量b kJ,B中C的浓度分别为![]() mol/L,放出热量c kJ。请回答下列问题:
mol/L,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小: ![]() _____
_____![]() (填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 molA2和2 molB2,在500℃时达到平衡后C的浓度为![]() mol/L,则
mol/L,则![]() 、
、![]() 的关系为_____。
的关系为_____。
(5)能说明A中已达到平衡状态的是_____(填序号,有一个或多个选项符合题意)。
a. ![]() (C)=2
(C)=2![]() (B2) b. 容器内气体压强保持不变
(B2) b. 容器内气体压强保持不变
c. 容器中气体的平均相对分子质量不随时间而变化 d. 容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b. 适当升高温度 c. 增大B2的浓度 d. 选择高效的催化剂
【答案】 减小 ![]()
![]() 减小
减小 ![]() bc c
bc c
【解析】(1)该反应为放热反应,温度升高,平衡左移,反应的平衡常数将减小;正确答案:减小。
(2)A是恒容容器,B是恒压容器,反应2A 2(g)+B2(g)![]() 2C(g)发生后,气体的物质的量之和减小,所以B相当于在A的基础上加压,增大了压强,B容器内的反应向右移动,C的浓度增大,放出的热量增加;正确答案:
2C(g)发生后,气体的物质的量之和减小,所以B相当于在A的基础上加压,增大了压强,B容器内的反应向右移动,C的浓度增大,放出的热量增加;正确答案: ![]() ;
; ![]() 。
。
(3)若打开K,因为B端的压强大于A端的压强,所以B中压强会减小,活塞P会向左移动,故容器B的体积将减小;正确答案:减小。
(4)若让A、B体积相等且固定P,相当于恒温恒容, B中改充入4 molA2和2 molB2,气体总量是A中气体总量的2倍,气体总量按比例增加相当于加压,压强增大会引起平衡右移,所以![]() ;正确答案:
;正确答案: ![]() 。
。
(5)没有标明两种物质的正、逆反应方向,无法判定反应达到平衡状态,a错误;该反应是一个反应前后气体总量发生变化的反应,所以容器内气体压强保持不变,可以判定反应达到平衡状态,b正确; 反应前后气体的总质量不变,反应前后气体的总量发生变化,根据M=m/n,m不变,n变化,当M不变时,反应达到平衡状态;c正确;恒温恒容,气体的总体积不变,反应前后气体的总质量不变,根据密度计算公式ρ=m/V, m不变,V不变,密度始终不变,无法判定反应达到平衡状态,d错误;正确选项bc。
(6)及时分离出C气体,相当于减少浓度,反应速率减慢,a错误;该反应正反应放热,升高温度,反应速率增大,平衡左移,b错误;增大B2的浓度,反应速率增大,平衡右移,c正确;选择高效的催化剂,化学反应速率增大,平衡不移动,d错误;正确选项c。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氯的制备、应用等环节。回答下列问题:
(1)氢气的制备
以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。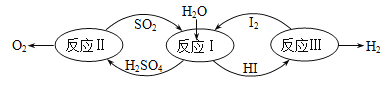
反应Ⅱ包含两步反应:
①H2SO4(1)=SO3(g)+H2O(g) ΔH=177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H=196kJ/mol
写出反应Ⅱ的热化学反应方程式__________
(2)氯气的应用
CO2加氢制备甲酸(HCOOH)可用于回收利用CO2。温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)![]() HCOOH(g) △H,化学平衡常数K=1
HCOOH(g) △H,化学平衡常数K=1
实验测得:v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当CO2的转化率为33.3%时,HCOOH的体积分数为_____(保留整数)。
②T1时,k逆=_________(用k正表示)。当升高温度至T2时,k逆=0.9k正,则△H____0(填“>”、“<"或“=”)。
③采用电还原法也可将CO2转化为甲酸根,用Sn为阴极、Pt为阳极,KHCO3溶液为电解液进行电解。CO2应通入______区(填“阳极”或“阴极”),其电极反应式为__________
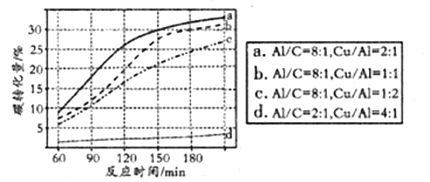
④可用NaHCO3代替CO2作为碳源加氢制备甲酸。向反应器中加入NaHCO3水溶液、A1粉、Cu粉,在300℃下反应。NaHCO3用量一定时,Al、Cu的用量对碳转化量影响结果如图。由图可知,曲线d相对其它三条曲线碳转化量变化不大的主要原因是__________,当碳转化量为30%时所采用的实验条件是____________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的一氧化碳还原4.64 g某金属氧化物,把生成的二氧化碳全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此金属氧化物是下列中的( )
A. 氧化铜 B. 氧化铁 C. 四氧化三铁 D. 二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1mol/LNaOH溶液分别滴加到0.1mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,下列说法不正确的是
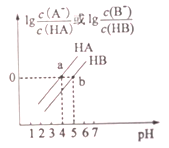
A. Ka(HB)<Ka(HA)
B. a点时,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaA溶液的pH大于0.1mol/LNaB溶液的pH
D. 向HB溶液中加入NaOH溶液,混合溶液中c(B-)/c(HB)=10[pH-pKa(HB)](已知:pKa=-lgKa)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]铃兰醛具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰、东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如下图所示:

(1)B中官能团的名称是 ;
(2)④的反应类型是 ;
(3)写出反应②的化学方程式 ;
(4)乌洛托品的结构式如图所示,其二氯取代物有 种;

将甲醛的水溶液与氨水混合蒸发可制得乌洛托品,该反应的化学方程式 ;
(5)写出满足下列条件的A的同分异构体
Ⅰ.有两个取代基; Ⅱ.取代基在邻位。
(6)已知:![]() 。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸
。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸 的合成路线流程图(无机试剂可以任选):
的合成路线流程图(无机试剂可以任选):
CH3CH2CHO→ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18纵行,下图中实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自构造原理最后填入的电子的能级符号。
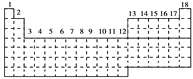
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影![]() 和
和![]() 表示d区和ds区____。
表示d区和ds区____。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在__________区。
(3)在元素周期表中4s轨道半充满的元素为__________(填元素符号)
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法错误的是
A. CH4是沼气、天然气和煤矿坑道气的主要成分
B. 乙烯和丙烯可通过石油裂解的方法大量获得
C. 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D. 苯不能使KMnO4溶液退色,因此苯不能发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com