
【题目】某种橡胶分解产物为碳氢化合物,对这种碳氢化合物作如下实验:
①若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过石灰水,石灰水增重2.2 g。
②经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍。
③该碳氢化合物0.1 mol能和32 g溴起加成反应.
④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。
下列说法正确的是
A. 该碳氢化合物为2-甲基-1,3-戊二烯
B. 该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物
C. 该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物
D. 该碳氢化合物与足量氢气加成时可以生成正戊烷
【答案】B
【解析】试题分析:①若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72g为燃烧生成水的质量,物质的量=![]() =0.04mol,再通过石灰水,石灰水增重2.2g为燃烧生成二氧化碳的质量,其物质的量=
=0.04mol,再通过石灰水,石灰水增重2.2g为燃烧生成二氧化碳的质量,其物质的量=![]() =0.05mol,则该碳氢化合物分子中C、H原子数目之比=0.05mol:0.04mol×2=5:8,其最简式为C5H8;②该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍,则其相对分子质量=34×2=68,故有机物分子式为C5H8,其不饱和度=
=0.05mol,则该碳氢化合物分子中C、H原子数目之比=0.05mol:0.04mol×2=5:8,其最简式为C5H8;②该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍,则其相对分子质量=34×2=68,故有机物分子式为C5H8,其不饱和度=![]() =2;③该碳氢化合物0.1mol能和32g溴起加成反应,溴的物质的量=
=2;③该碳氢化合物0.1mol能和32g溴起加成反应,溴的物质的量=![]() =0.2mol,碳氢化合物与溴的物质的量之比为1:2,故碳氢化合物分子中含有2个C=C键或1个-C≡C-键;④经分析,在③的生成物中,溴原子分布在不同的碳原子上,说明碳氢化合物分子中含有2个C=C键,且溴代物中有一个碳原子在支链上,故该碳氢化合物的结构简式为:CH2=CH-C(CH3)=CH2;A.该碳氢化合物为CH2=CH-C(CH3)=CH2,名称为2-甲基-1,3-丁二烯,故A错误;B.与溴单质1:1加成时可以发生1,2-加成或1,4-加成,生成3种不同的产物:BrCH2CH(Br)-C(CH3)=CH2,CH2=CH-CBr(CH3)CH2Br,BrCH2CH=C(CH3)CH2Br,故B正确;C.由B中分析可知,与溴单质1:1加成时可以发生1,2-加成或1,4-加成,生成3种不同的产物,故C错误;D.该碳氢化合物与足量氢气加成时生成CH3CH2-C(CH3)CH3,为异戊烷,故D错误,故选B。
=0.2mol,碳氢化合物与溴的物质的量之比为1:2,故碳氢化合物分子中含有2个C=C键或1个-C≡C-键;④经分析,在③的生成物中,溴原子分布在不同的碳原子上,说明碳氢化合物分子中含有2个C=C键,且溴代物中有一个碳原子在支链上,故该碳氢化合物的结构简式为:CH2=CH-C(CH3)=CH2;A.该碳氢化合物为CH2=CH-C(CH3)=CH2,名称为2-甲基-1,3-丁二烯,故A错误;B.与溴单质1:1加成时可以发生1,2-加成或1,4-加成,生成3种不同的产物:BrCH2CH(Br)-C(CH3)=CH2,CH2=CH-CBr(CH3)CH2Br,BrCH2CH=C(CH3)CH2Br,故B正确;C.由B中分析可知,与溴单质1:1加成时可以发生1,2-加成或1,4-加成,生成3种不同的产物,故C错误;D.该碳氢化合物与足量氢气加成时生成CH3CH2-C(CH3)CH3,为异戊烷,故D错误,故选B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钡与盐酸反应2H++BaCO3===Ba2++H2O+CO2↑
B. 氢氧化钡溶液与稀硫酸混合Ba2++![]() +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
C. 金属钠与水的反应 Na+H2O===Na++OH-+H2↑
D. 铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2-硝基-1,3-苯二酚是橘黄色固体,易溶于水、溶液呈酸性,沸点为88℃,是重要的医药中间体。实验室常以间苯二酚为原料分以下三步合成:

具体实验步骤如下:
①磺化:称取5.5g碾成粉状的间苯二酚放入烧杯中,慢慢加入浓硫酸并不断搅拌,控制温度为60~65℃约15min。
②硝化:将烧杯置于冷水中冷却后加入混酸,控制温度(25±5) ℃左右继续搅拌15min。
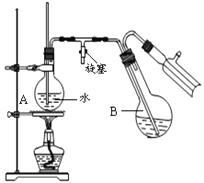
③蒸馏:将反应混合物移入圆底烧瓶B中,小心加入适量的水稀释,再加入约0.1g尿素,然后用下图所示装置进行水蒸气蒸馏;将馏出液冷却后再加入乙醇-水混合剂重结晶。
回答下列问题:
(1)实验中设计Ⅰ、Ⅲ两步的目的是__________________________。
(2)硝化步骤中制取“混酸”的具体操作是_________________________________________。
(3)写出步骤Ⅱ的化学方程式__________________________________________________.
(4)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能_____________.
(5)步骤②的温度应严格控制不超过30℃,原因是_________________________。
(6)步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇-水混合剂洗涤。请设计简单的实验证明2-硝基-1,3-苯二酚已经洗涤干净:__________________________________________________。
(7)本实验最终获得1.55g橘黄色固体,则2-硝基-1,3-苯二酚的产率约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:
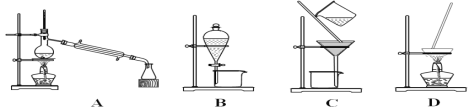
①分离植物油和水,选择装置______(填序号),主要使用仪器名称______;
②分离乙二醇和丙三醇的混合溶液,选择装置______(填序号)。
物质 | 熔点 (摄氏度) | 沸点(摄氏度) | 密度(g/cm-3) | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比例互溶 |
(2)实验室需配制250mL0.1mol·L-1的Na2CO3溶液,填空并回答下列问题:
①配制250mL0.1mol·L-1的Na2CO3溶液,实际应称取Na2CO3的质量是______g,实验过程中所需的玻璃仪器有______。
②若在溶液配制过程中出现如下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”)
若容量瓶中有少量蒸馏水__________;若定容时俯视刻度线__________。
(3)焦炭与浓硫酸加热条件下发生如下反应:C +2H2 SO4(浓)=2SO2↑+ CO2↑ +2H2O,当反应中转移2mole—时,生成SO2的体积(标准状况)是____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO![]() 、SO
、SO![]() 、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO
、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO![]() 不共存)
不共存)

(1)水样中一定含有的阴离子是_____,其物质的量浓度之比为_____.
(2)写出BC段所表示反应的离子方程式:_____.
(3)由B到C点变化过程中消耗硝酸的体积为_____.
(4)试根据实验结果推测K+是否存在?_____(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是_____.(若K+不存在,则不必回答该问).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均
HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均![]() 为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
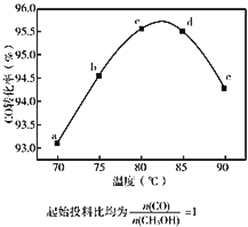
A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C. d点和e点的平衡常数:Kd < Ke
D. a点对应的CO的转化率与CH3OH的转化率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO![]() 的溶液:H+、K+、Cl—、SO32—
的溶液:H+、K+、Cl—、SO32—
B. 中性溶液:Fe3+、Al3+、NO3—、SO42—
C. ![]() =1×10—12的溶液:K+、AlO2—、CO32—、Na+
=1×10—12的溶液:K+、AlO2—、CO32—、Na+
D. 由水电离出的c(H+)=10—12 mol·L1的溶液:Na+、K+、CO32—、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com