


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
| A、反应混合物中 A、B、C、D 的质量分数都不再变化 |
| B、反应混合物中 A、B、C、D 的分子数相同 |
| C、反应混合物的压强保持不变 |
| D、单位时间内生成 a mol C,同时生成a mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、钾(K)原子基态的原子结构示意图为 |
B、H2O电子式为 |
C、O的原子基态电子的轨道表示式为 |
| D、Ca2+离子基态电子排布式为1s22s22p63s23p64s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CHOH) |
| n(CO) |
| 容器 | 甲 | 乙 | 丙 |
| 投料量 | 1mol CO、2mol H2 | 1molCH3OH | 2molCH3OH |
| CH3OH的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
| ||
| (一定条件) |
查看答案和解析>>
科目:高中化学 来源: 题型:
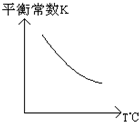 工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、压强不变,充入氮气使容器体积增大 |
| B、将容器的体积缩小一半 |
| C、增加铁的量 |
| D、体积不变,充入氮气使容器压强增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com