
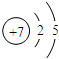 .
.分析 (I)(1)N元素原子核外有7个电子,分两层排布;
(2)NaNO2属于强碱弱酸盐,其溶液显弱碱性,在酸性条件下有强氧化性,NaCl与硝酸银生成难溶于强酸的沉淀;
(3)在溶液中氯气与NO2-发生氧化还原反应生成NO3-和Cl-;
(II)(1)红棕色粉末为氧化铁,不含结晶水的盐为硫酸钾,根据数据计算出A中仅含有O、K、Fe三种元素的个数比,即得A的化学式;A不稳定,生成的红褐色沉淀为氢氧化铁,气体单质只能是氧气,据钾守恒,产物还有氢氧化钾,由此写出方程式配平即可;
(2)三价铁离子被次氯酸钾氧化为高铁酸钾,次氯酸钾被还原为氯化钾,同时生成H2O,由此写出方程式配平即可;
(3)根据题给信息:在常温和干燥的条件下,化合物A可以稳定的存在,但它具有强氧化性在水溶液中不稳定,由于是在强碱性条件下反应制得,所以提高溶液的碱性可以提高其稳定性,据此分析;
(4)固定其他条件,改变温度,看析出沉淀的快慢.
解答 解:(Ι)(1)N元素原子核外有7个电子,分两层排布,K层有2个电子,L层有5个电子,其原子结构示意图为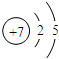 ,故答案为:
,故答案为: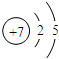 ;
;
(2)A.NaNO2属于强碱弱酸盐,其溶液显弱碱性,NaCl溶液显中性,所以测定这两种溶液的pH,可以鉴别二者,故A正确;
B.甲基橙在中性或碱性溶液中显黄色,NaNO2和NaCl溶液分别显碱性和中性,所以分别在两种溶液中滴加甲基橙均为黄色,无法鉴别,故B错误;
C.在酸性条件下NaNO2有强氧化性,加入KI-淀粉溶液,溶液会变蓝色,而在NaCl溶液中加KI-淀粉溶液无变化,所以可以区别二者,故C正确;
D.NaCl与硝酸银生成难溶于强酸的沉淀,而NaNO2和AgNO3溶液反应生成的AgNO2是易溶于酸,所以用AgNO3和HNO3两种试剂能区别二者,故D正确.
故答案为:B;
(3)在溶液中氯气与NO2-发生氧化还原反应生成NO3-和Cl-,则把新制的氯水加到NaNO2溶液中发生反应的离子方程式为:Cl2+NO2-+H2O═NO3-+2Cl-+2H+;
故答案为:Cl2+NO2-+H2O═NO3-+2Cl-+2H+;
(II)(1)3.96g化合物A含铁:$\frac{1.6g}{160g/mol}$×2=0.02mol,含钾:$\frac{10.44g}{174g/mol}$×2-0.08mol=0.04mol,
含氧:$\frac{3.96g-0.02mol×56g/mol-0.04mol×39g/mol}{16g/mol}$=0.08mol,
钾、铁、氧的个数比为:0.04mol:0.02mol:0.08mol=2:1:4,故A的化学式为:K2FeO4;
高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为4KFeO4+10H2O=4Fe(OH)3↓+3O2↑+8KOH;
故答案为:K2FeO4;4KFeO4+10H2O=4Fe(OH)3↓+3O2↑+8KOH;
(2)三价铁离子被次氯酸钾氧化为高铁酸钾,次氯酸钾被还原为氯化钾,同时生成H2O,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl?+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl?+5H2O;
(3)根据题给信息:在常温和干燥的条件下,化合物A可以稳定的存在,但它具有强氧化性在水溶液中不稳定,由于是在强碱性条件下反应制得,所以提高溶液的碱性可以提高其稳定性,
A.高铁酸钾在水溶液中不稳定,醋酸钠溶液显碱性,在溶液中加醋酸钠可以提高其稳定性,故A正确;
B.亚硫酸钠具有还原性,会被高铁酸钾氧化,故B错误;
C.加Fe(NO3)3不能提高溶液的碱性,所以不能提高高铁酸钾的稳定性,故C错误;
D.在溶液中加KOH能提高溶液的碱性,所以能提高高铁酸钾的稳定性,故D正确;
故答案为:AD;
(4)固定其他条件,改变温度,看析出沉淀的快慢,则设计实验为取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢,
故答案为:取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢.
点评 本题考查学生阅读题目获取信息的能力、计算能力、设计实验能力等,题目较难,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(H2A) | c(NaOH) | ||
| ① | X | 0.10 | 9 |
| ② | 0.10 | 0.10 | 5 |
| A. | X<0.1 | |
| B. | HA-的电离程度大于水解程度 | |
| C. | 将实验①所得溶液加水稀释后,$\frac{c({A}^{2-})}{c(H{A}^{-})}$变大 | |
| D. | 实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;用电子式表示D元素和G元素形成化合物的过程:
;用电子式表示D元素和G元素形成化合物的过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
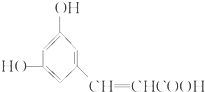
| A. | X分子中最多可有9个碳原子共平面 | |
| B. | X可以发生取代、加成、消去、聚合等反应 | |
| C. | 1 mol X与足量NaHCO3溶液反应所得物质的分子式为C9H7O4Na | |
| D. | 苯环上的取代基与X完全相同的X的同分异构体有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的熔点和沸点都很高 | |
| B. | H2O、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素X与氯形成化合物时,化学式可能是XCl | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
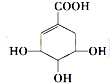
| A. | 分子式为C7H6O5 | |
| B. | 分子中含有的官能团有羟基、酯基、碳碳双键 | |
| C. | 可发生加成反应、取代反应、氧化反应、还原反应 | |
| D. | 在水溶液中羧基和羟基均能电离出H+,1mol达菲可与4mol Na反应生成2 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 香芹酮化学式为C10H14O | |
| B. | 香芹酮可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮分子中有3种官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com