
| A、22.4LNO气体中含有的分子数为NA |
| B、标准状况下,22.4LH2O中含有的水分子数为NA |
| C、常温常压下,11.2LH2中含有的氢分子数为0.5NA |
| D、在标准状况下22.4LCO中含有CO分子的个数为NA |


科目:高中化学 来源: 题型:

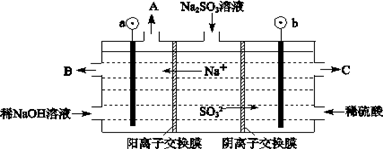
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、油脂、蛋白质都能水解,且水解产物各不相同 |
| B、从煤的干馏产物中可以获得焦炉气、粗氨水、煤焦油、焦炭等重要的化工原料 |
| C、石油催化裂化的主要目的是提高芳香烃的产量 |
| D、核酸是一类含磷的生物高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 | ||||
B、惰性电极电解氯化铝溶液:2Cl-+2H2O
| ||||
| C、镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O | ||||
| D、将10 mL 0.1 mol?L-1 KAl(SO4)2溶液和10 mL 0.2 mol?L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤ | B、②③④⑤ |
| C、②⑤⑥⑦ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-) |
| B、C(Na+)>C(HCO3-)>C(CO32-)>C(OH-) |
| C、C(Na+)>[C(CO32-)+C(HCO3-)+C(H2CO3)] |
| D、C(CO32-)>C(HCO3-)>C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com