
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 1:1 |
分析 先根据方程式求出H2和C3H8的燃烧热,设H2的物质的量为nmol,则C3H8的物质的量为5mol-n,根据放出的热量列方程式解答即可.
解答 解:设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n,
由热化学方程式可知1molH2、1molC3H8完全燃烧放出的热量分别为285.8kJ、2220kJ,
则:285.8kJ/mol×n+2220.0kJ/mol×(5mol-n)=3847kJ,
解得:n=3.75mol,
C3H8的物质的量为5mol-3.75mol=1.25mol,
相同条件下气体的体积之比等于物质的量之比,
所以混合气体中H2与C3H8的体积比=物质的量之比=3.75 mol:1.25 mol=3:1,
故选B.
点评 本题以热化学反应方程式为载体考查根据方程式计算,题目难度中等,试题侧重考查学生的分析能力及计算能力,注意熟练掌握基本公式并能够灵活运用.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:选择题
下列关于如图所示电化学装置的分析正确的是
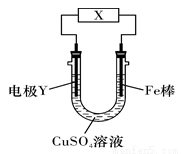
A.若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出
B.若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C.若X为电流计,Y为锌棒,则SO42-移向Fe棒
D.若X为导线,Y为铜棒,则Fe棒发生还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:选择题
继科学家发现C3O2是金星大气成分之后,2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质。已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C3O2与硫化羰的说法中正确的是
A.C3O2可以在氧气中完全燃烧生成CO2
B.C3O2和CO2都是碳的氧化物,它们互为同分异构体
C.COS是由极性键构成的非极性分子,分子中所有原子都满足8电子稳定结构
D.COS在氧气中完全燃烧后,生成物是CO2和SO3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用 | |
| B. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| C. | 使用pH试纸测定溶液pH时先润湿,则测得溶液的pH会发生变化 | |
| D. | 用惰性电极电解NaCl溶液一段时间后,再加入盐酸可使溶液与原溶液完全一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室制取氨气的装置图,请回答下列问题:
如图是实验室制取氨气的装置图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |
| 2 | 4 | 1.6 | 2.4 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ①④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com