
| A. | D元素处于元素周期表中第二周期VIA族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物具有相似的物理性质和化学性质 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
分析 短周期元素A、B、C、D的原子序数依次递增,B与D为同主族元素,B的原子序数大于A,故B处于第二周期,D处于第三周期,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,四元素原子最外层电子数之和为10,故B、D的最外层电子数为$\frac{10-1-1}{2}$=4,故B、D处于ⅣA族,则B为碳元素,D为Si元素,C元素原子序数大于碳元素,故C为Na元素,四元素原子序数之和为32,故A元素的原子序数为32-14-6-11=1,则A为H元素,据此解答.
解答 解:短周期元素A、B、C、D的原子序数依次递增,B与D为同主族元素,B的原子序数大于A,故B处于第二周期,D处于第三周期,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,四元素原子最外层电子数之和为10,故B、D的最外层电子数为$\frac{10-1-1}{2}$=4,故B、D处于ⅣA族,则B为碳元素,D为Si元素,C元素原子序数大于碳元素,故C为Na元素,四元素原子序数之和为32,故A元素的原子序数为32-14-6-11=1,则A为H元素.
A.D为Si元素,处于元素周期表中第三周期第IVA族,故A错误;
B.H原子半径最小,同主族电子层数越多原子半径越大,同一周期从左到右原子半径逐渐减小,则原子半径为A(H)<B(C)<D(Si)<C(Na),故B错误;
C.B、D的最高价氧化物分别为CO2、SiO2,前者属于分子晶体,后者属于原子晶体,二者物理性质不相似,故C错误;
D.高温条件下,碳和二氧化硅发生置换反应生成Si,钠和水发生置换反应生成氢气,故D正确;
故选D.
点评 本题考查位置结构性质的关系,根据B的原子序数大于A,结合B、D为同主族元素,明确元素B为第二周期元素是解答本题的关键,侧重考查学生分析推理能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
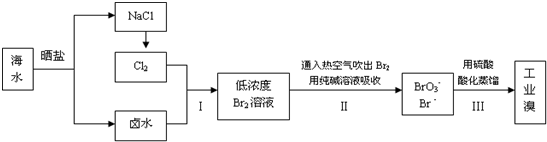
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热法可以除去氯化铵中的少量碘单质 | |
| B. | 向试液中滴加双氧水和KSCN溶液,溶液变为红色,则试液中一定含Fe2+ | |
| C. | 向某固体中滴加稀硫酸,产生气体能使澄清石灰石变浑浊,则该固体一定是苏打或小苏打 | |
| D. | 向含少量硫酸铁的硫酸铜溶液中加入过量的氧化铜,过滤,得到纯净硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Cl2溶于水中,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24L CH3Cl含有的质子数目是2.3NA | |
| C. | 25℃时,1L pH=4的CH3COOH溶液中,水电离出的H+数目为10-4NA | |
| D. | 标准状况下,4.48L NO与2.24L O2混合后,所得气体中含有原子数目为0.6NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
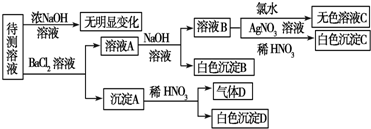
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
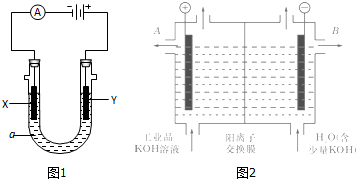
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汤姆生根据α粒子散射实验提出了“葡萄干面包式”的原子结构模型 | |
| B. | 石油的裂化是为了获得乙烯、丙烯这样的短链烃 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com