
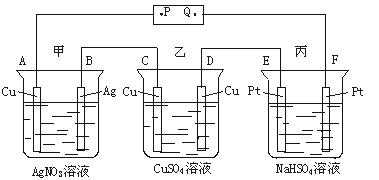
A.P是电源的正极
B.F极上发生的反应为:4OH--4e-====2H2O+O2↑
C.电解时,甲、乙、丙三池中,除了E、F两极外,其他电极均参加反应
D.通电后,甲池溶液的pH减小,而乙、丙两池溶液的pH不变
解析:此题属电化学的综合题,涉及原电池、电解池、电镀池的有关问题。由于一些学生未掌握判断电极名称的原理和方法,缺乏电极反应以及分析电解液pH变化等知识,以致解此题时出现错选。此题A、C、D项都是错误的。选A项,错误原因在于未理解“阴极还原”“负极连阴极”的判断电极的原理。A极析出Ag,说明溶液中的Ag+在A极得到电子被还原成Ag,故A极为阴极,则P极为电源的负极。显然A选项错误。选C项,错在只注意惰性电极不参加反应,不清楚阴极不论是否是惰性电极均不参加电极反应,此装置中的A、C两电极作为阴极未参加电极反应。故C项错误。选D项,是由于不知道如何依据电解原理分析电解液pH的变化而出现错误。甲池、乙池均为电镀池,电解液的pH均不变;丙池是电解NaHSO4溶液,实际是电解水。由于NaHSO4水溶液显酸性,电解后,溶液浓度增大,c(H+)亦增大,溶液的pH减小。故D项也不正确。B选项,F极为阴极且为惰性电极,水电离出来的OH-在F极失去电子,发生氧化反应4OH--4e-====2H2O+O2↑。故B项正确。
答案:B


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com