
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 6 | 8 | 11 | 13 |
| 元素符号 | ||||
| 周期 | ||||
| 族 |
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 6 | 8 | 11 | 13 |
| 元素符号 | C | O | Na | Al |
| 周期 | 2 | 2 | 3 | 3 |
| 族 | IVA | VIA | IA | ⅢA |
| ||
| ||
| ||
| ||
| ||
| ||


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

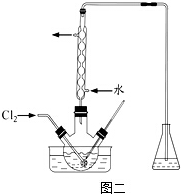
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
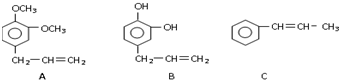
| 氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
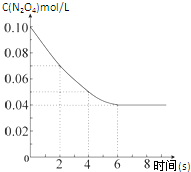 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
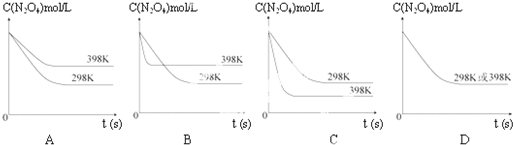
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石、白磷都属于单质 |
| B、漂白粉、石英都属于纯净物 |
| C、氯化铵、次氯酸都属于强电解质 |
| D、葡萄糖、蛋白质都属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com