
分析 (1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O;根据原子守恒判断a、c关系;
Na2FeO4具有强氧化性,被还原后生成铁离子,铁离子水解生成的Fe(OH)3胶体具有吸附性;
(2)①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6;
②该反应中Fe元素化合价由+3价升高到+6价,Cl元素化合价由+1价变为-1价,转移电子数为6,根据转移电子和高铁酸根离子之间关系式计算转移电子物质的量、根据转移电子和还原产物之间关系式计算还原产物物质的量.
解答 解:(1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O,配平后方程式为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,则由原子守恒可知a=4+2c;
故答案为:Na2O;a=4+2c;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解氢氧化铁胶体,胶体具有吸附性能吸附除去水中的悬浮杂质,
故答案为:高铁酸钾具有强氧化性,能杀菌消毒,且消毒过程中自身被还原成铁离子,铁离子水解氢氧化铁胶体能吸附除去水中的悬浮杂质;
(2 )①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6,溶液在碱性条件下进行,则氢氧化根离子参加反应,生成水,反应方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中Fe元素化合价由+3价升高到+6价,则该反应中转移电子数为6,每生成1mol FeO42-转移电子物质的量=$\frac{6mol}{2}$=3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量=$\frac{0.3mol}{6}$=0.15mol,
故答案为:3;0.15.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,正确判断各个物理量之间关系式是解本题关键,难点是化学反应方程式的配平,要注意原子守恒、转移电子守恒及电荷守恒,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na+ H+ NO3- Fe2+ | B. | Ca2+ NO3- HCO3- OH- | ||
| C. | K+ H+ Cl- SO42- | D. | Fe3+ Cl- H+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 75% | C. | 80% | D. | 85% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
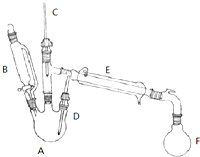 溴乙烷是有机合成中的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成中的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com