
元素的原子结构决定其性质和周期表中的位置.下列说法正确的是( )
A. 元素原子的最外层电子数等于元素的最高化合价
B. 多电子原子中,在离核较近的区域内运动的电子能量较高
C. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
D. Si、P、S得电子能力和最高价氧化物对应水化物的酸性均依次增强
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液,溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色 | Fe3+的氧化性大于I2 |
C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀 | 蛋白质均发生了变性 |
D | 将0.1 mol·L-1,MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol • L-1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:实验题
直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。
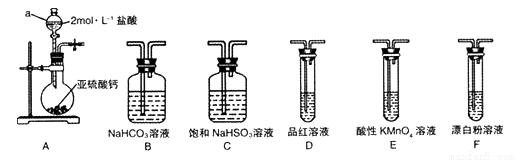
(1)装置A中仪器a的名称为__________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理________________。
(2)选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学设计的合理实验方案为:按照A→C→_________→F→尾气处理(填字母) 顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_____________________。
③其中装置C的作用是__________。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,则该溶液中所有离子的浓度由大到小的顺序为__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)为了测定装置A残液中SO2的含量,量取10.00 mL残液于圆底烧瓶中,加热使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反应后,再用0.2000mol/L的KI标准溶液滴定过量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为_______g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,使测定结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期.下列有关推测正确的是( )
A. XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B. XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C. XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D. XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下面是元素周期表的一部分(表中数字和X代表原子序数),其中X为53的是
A. 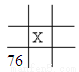 B.
B. 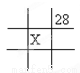 C.
C. 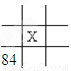 D.
D. 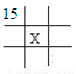
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:填空题
CO2是温室气体,研究CO2的应用对促进低碳生活具有重要意义。
(1)1922年德国工业化生产尿素
Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
Ⅱ:NH3COONH4(s)  CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
①写出用NH3和CO2合成尿素总反应的热化学方程式_________;按照酸碱质子理论,能接受H+的物质为碱,现常温下溶液中存在反应:NH3+NH2COOH NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
②在一个体积恒为1L的恒温密闭容器中充入2molCO2和4molNH3的混合气体,经历反应Ⅰ、Ⅱ合成CO(NH2)2,混合气体中的氨气体积分数及气体总浓度随时间变化如下图所示。

对于反应Ⅰ:A点的正反应速率与B点的逆反应速率的大小关系是:v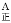 _______v
_______v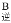 (填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
(填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能_______(“增大”“减小”或“不变”)
(2)利用二氧化碳制备乙烯
用惰性电极电解强酸性二氧化碳水溶液可得到乙烯,其原理如下图所示。
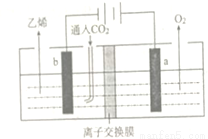
①b电极上的电极反应式为______________;
②该装置中使用的是___________(填“阴” 或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:选择题
下列过程对应的离子方程式正确的是
A. NaHSO3溶于水呈酸性:NaHSO3=Na++H++SO32-
B. 在Na2S2O3溶液中滴加稀硫酸:2H++S2O32- = SO2↑+S↓+H2O
C. 浓盐酸与MnO2反应制氯气:MnO2+4HCl=Mn2++2Cl2+2H2O
D. 工业冶炼Mg:2Mg2++2O2- 2Mg+O2↑
2Mg+O2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下图是喷泉实验装置图,下列说法正确的是
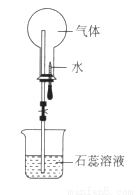
A. 烧瓶中的溶液呈红色,则原气体一定是SO2
B. 烧瓶中的溶液呈蓝色,则原气体可能是NH3
C. 形成喷泉的原因是烧瓶内压强大于外界大气压
D. 若将石蕊改成氢氧化钠,则CO、CO2均能形成喷泉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省、惠安一中、泉州实验中学高一上学期期末联考化学试卷(解析版) 题型:填空题
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为___________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:___________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是______________。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:______________________。
(5)某混合物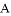 ,含有
,含有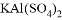 、
、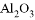 和
和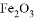 ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
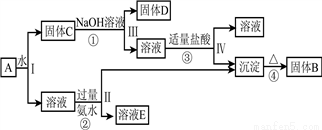
据此回答下列问题:
①写出固体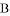 、
、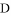 的化学式:B________;D__________;
的化学式:B________;D__________;
②写出D与稀硫酸反应的化学方程式:__________________;
写出反应①的离子方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com