
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
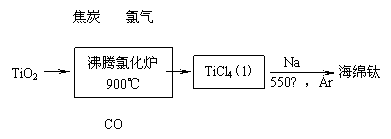

① 沸腾氯化炉中发生的主要反应为: 。
② 已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则:TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如下图所示,二氧化钛电极连接电源 极,该极电极反应为:
。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种无毒的还原性气体,该气体是 。


(3)海绵钛可用碘提纯,原理为: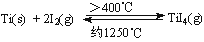 ,下列说法正确的是 。
,下列说法正确的是 。
A.该反应正反应的ΔH>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2 可循环利用
【知识点】盖斯定律的应用 电解原理F4 F5
【答案解析】(每空2分,本题共12分)
(1)①TiO2+2C+2Cl2  TiCl4+2CO(高温或900℃要注明); ②2b-4c-a;
TiCl4+2CO(高温或900℃要注明); ②2b-4c-a;
(2)负; TiO2 +4e-=Ti + O2-(或:Ca2++2e-=Ca;2Ca+TiO2=2CaO +Ti); H2
(3)C D(只选对1个给1分,错选0分)
解析::(1)根据流程可知沸腾炉中反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,反应的化学方程式为:TiO2+2C+2Cl2=TiCl4+2CO;
②(I) Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;
(II) 2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;
(III) Na(s)=Na(l)△H=ckJ/mol,
将方程式2(II)-(I)-4(III)得TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s),△H=2b-4c-a;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连;电极反应式为TiO2+4e-=Ti+2O2-,阴极上加入的物质应该具有还原性且是气体,反应后的生成物没有污染,水没有污染,所以该气体是氢气;
(3)A、大多数化合反应是放热反应,该反应的正反应也是放热反应,则该反应正反应的△H<0,故A错误;
B、高于400℃,钛和氯气反应生成四氯化钛,在1250℃四氯化钛分解,所以在不同温度区域,TiI4的量不同,故B错误;
C、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的作用是将粗钛从低温区转移到高温区,故C正确;
D、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的量不变,可以循环利用故D正确;
故选CD.
【思路点拨】本题考查电极反应式的书写、热化学反应等知识点,重视利用盖斯定律进行有关计算。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确加入顺序操作是 ,
.为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 )
(2)写出试管a中该反应化学方程式 ;
(3)实验中加热试管:
①开始时要小火加热的目的是:
②加热一段时间后改为大火加热至沸腾的目的是: 3加热至沸腾后再改为小火加热的目的是:
(4)试管b中加有饱和Na2CO3溶液,其作用是:
(5)试管b中导气管不插入液面下的目的是: 防 .

查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
|
| A. | 单位时间内生成3n molA2,同时消耗2n molAB |
|
| B. | 容器内,3种气体AB、A2、B2共存 |
|
| C. | AB的消耗速率等于A2的消耗速率 |
|
| D. | 容器中各组分的物质的量分数不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO3(g)⇌2SO2)(g)+O2(g),若在一定温度下,将2mol SO3放入体积为2L的密闭容器中,当达到平衡状态时,测得O2的物质的量为0.6mol,求该反应的平衡常数.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或结论正确的是
A.配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水
B.实验室里需要480 mL 2.0 moI·L-1氢氧化钠溶液,配制溶液时先称量氢氧化钠固38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
C. 25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变
D. K2CO3在酒精灯上灼烧时能直接观察到紫色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是( )
A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反
B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料
C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸
D.Z的氢化物比X的氢化物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均是短周期元素,A和B同周期,A和C同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,E是所在周期中原子半径最小的元素,请回答。
(1)C在元素周期表中的位置是_______.
(2)D2B的电子式是___________;AB2的结构式是____________.
(3)B、D、E离子半径的由大到小的顺序为___________;(用离子符号回答)A、C、E最高价氧化物对应水化物的酸性由强到弱的顺序为_________.(用化学式回答)
(4)A、B气态氢化物沸点高的是___________;(用化学式回答)原因_____________.
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生以为,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀,当消耗13.50g EB2时,共转移了1mol电子,则反应的离子方程式为_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10﹣9m)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是()
A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置是实验室常用的一种制取气体的装置.
(1)下列制取气体的反应,可利用此装置进行制取有 (不一定是单选,多选漏选均不得分).
A、石灰石和稀硫酸反应制CO2 B、锌和稀盐酸反应制H2
C、MnO2催化双氧水分解制O2 D、KClO3和MnO2加热反应制取O2
(2)利用此装置制取H2并还原氧化铜,稀硫酸应该装在 中,写出H2还原氧化铜的反应方程式 ,由反应可说明H2的还原性 Cu(填“强于”、“弱于”).向装有8g CuO的试管中通入H2,若要使CuO全部被还原,则至少需要标准状况下的H2体积为 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com