
| A. | pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14 | |
| B. | 将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸 | |
| C. | 测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| D. | 0.2 mol•L-1 H2A 溶液中的 c(H+)=a,0.1 mol•L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸 |
分析 A.电解质水溶液中在常温下存在离子积常数Kw=10-14,Na2A溶液中水电离出的氢氧根离子浓度等于水电离出的氢离子浓度;
B.将pH=a的H2A稀释为pH=a+l的过程中,若酸为强酸是原溶液稀释10倍,$\frac{c({H}_{2}A)}{c({H}^{+})}$不变,若为弱酸,稀释促进电离,比值减小;
C.NaHA溶液若PH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,也可能对应酸是弱酸;
D.0.2 mol•L-1 H2A 溶液中的 c(H+)=a,0.1 mol•L-1 H2A溶液中的 c(H+)=b,若a=2b说明H2A为强酸,若a<2 b,说明酸存在电离平衡.
解答 解:A.pH=a的Na2A溶液中氢离子浓度=10-amol/L,由水电离产生的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-a}}$=10a-14,故A正确;
B.将pH=a的H2A稀释为pH=a+l的过程中,若酸为强酸是原溶液稀释10倍,$\frac{c({H}_{2}A)}{c({H}^{+})}$不变,若为弱酸,稀释促进电离,$\frac{c({H}_{2}A)}{c({H}^{+})}$比值减小,故B正确;
C.NaHA溶液若pH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,如硫酸氢钠,也可能对应酸是弱酸,如亚硫酸氢钠,故C错误;
D.0.2 mol•L-1 H2A 溶液中的 c(H+)=a,0.1 mol•L-1 H2A溶液中的 c(H+)=b,若a=2b说明H2A为强酸,若a<2 b,说明酸存在电离平衡,证明为弱酸,故D正确;
故选C.
点评 本题考查了弱电解质电离平衡的应用判断,盐类水解的应用,溶液中电离平衡影响因素的分析,酸碱中和溶液酸碱性的理解应用,掌握基础是解题关键,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用图表示. 下列关于海洋氮循环的说法正确的是( )
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用图表示. 下列关于海洋氮循环的说法正确的是( )| A. | 海洋中的氮循环起始于氮的氧化 | |
| B. | 海洋中的氮循环属于固氮作用的是③ | |
| C. | 海洋中的反硝化作用一定有氧气的参与 | |
| D. | 向海洋排放含NO3-的废水会影响海洋中NH4+的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C溶于水后得到强碱溶液,则A可能是Na | |
| B. | 若向C溶液中逐滴加入NaOH溶液,溶液中出现白色沉淀并逐渐消失,则A可能Al | |
| C. | 若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2 | |
| D. | 若C的溶液中滴加NaOH产生白色沉淀,后白色沉淀消失,则B可能为Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1g37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78g | |
| C. | 7.8g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24L乙烷含有的共价键数为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
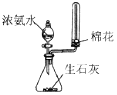 | 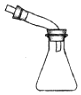 | 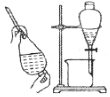 | 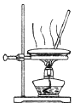 |
| 快速制备和收集一定量的氨气 | 蒸馏时的接收装置 | 用于分离C2H5OH和水混合物 | 直接蒸发氯化铁溶液获得氯化铁晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L的CO气体1molN2所含的电子数也相等 | |
| B. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 标准情况下将2.24LCl2通入到2L水中,充分反应后转移的电子数且小于0.1NA | |
| D. | 300mL2mol•L-1蔗糖溶液中所含分子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{H_{2}}$Al$→_{常温}^{浓H_{2}SO_{4}}$Al2(SO4)3 | |
| B. | H2SiO3$\stackrel{△}{→}$SiO2$→_{△}^{盐酸}$SiCl4 | |
| C. | SO2$\stackrel{CaCl_{2}(aq)}{→}$CaSO3$\stackrel{O_{2}}{→}$CaSO4 | |
| D. | CH3CH3$→_{光照}^{Cl_{2}}$CH3CH2Cl$→_{△}^{NaOH醇溶液}$CH2=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com