
��ѧƽ���ƶ�ԭ����ͬ��Ҳ����������ƽ�⣬��֪�ڰ�ˮ�д�������ƽ�⣺
NH3��H2O��![]() ��NH3?H2O��
��NH3?H2O��![]() �� NH4+��OH-
�� NH4+��OH-
��1����ˮ�м���MgCl2����ʱ��ƽ����__���� __�ƶ���OH����Ũ�Ƚ�__�� ____��
��2����ˮ�м���Ũ���ᣬƽ����___________�ƶ�����ʱ��Һ��Ũ�ȼ�С��������___________��___________��___________��
��3����Ũ��ˮ�м�������NaOH���壬ƽ����____ __�ƶ�����ʱ����������________��
(4)�봿ˮ��ȣ���ˮ��ˮ�ĵ���ij̶Ƚ������������� ��������С�������䡱��
 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��� | 5mlCuSO4��Һ | 10mlNaBr��Һ ��mol?L-1�� |
�� �� |
| �� | ��һ��CuSO4��Һ | a | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | b | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | c | ��Һ����ɫ��Ϊ����ɫ |
| ��� | 5mlCuSO4��Һ | 10mlNaBr��Һ ��mol?L-1�� |
�� �� |
| �� | d | ��һ��NaBr��Һ | ��Һ����ɫ��Ϊ����ɫ |
| �� | e | ��һ��NaBr��Һ | ��Һ����ɫ��Ϊ����ɫ |
| �� | f | ��һ��NaBr��Һ | ��Һ����ɫ��Ϊ����ɫ |
| ��� | 5mlCuSO4��Һ | 10mlNaBr��Һ ��mol?L-1�� |
�¶� | ���� |
| �� | ��һ��CuSO4��Һ | ��һ��NaBr��Һ | 25�� | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | ��һ��NaBr��Һ | 60�� | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | ��һ��NaBr��Һ | 75�� | ��Һ����ɫ��Ϊ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��� | 5mlCu2+��Һ��mol?L-1�� | 10ml Br-��Һ��mol?L-1�� | ���� |
| �� | ��һ��CuSO4��Һ | a | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | b | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | c | ��Һ����ɫ��Ϊ����ɫ |
| ��� | 5mlCu2+��Һ��mol?L-1�� | 10ml Br-��Һ��mol?L-1�� | ���� |
| �� | d | ��һ��NaBr��Һ | ��Һ����ɫ��Ϊ����ɫ |
| �� | e | ��һ��NaBr��Һ | ��Һ����ɫ��Ϊ����ɫ |
| �� | f | ��һ��NaBr��Һ | ��Һ����ɫ��Ϊ����ɫ |
| ��� | 5mlCu2+��Һ��mol?L-1�� | 10ml Br-��Һ��mol?L-1�� | �¶� | ���� |
| �� | ��һ��CuSO4��Һ | ��һ��NaBr��Һ | 25�� | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | ��һ��NaBr��Һ | 60�� | ��Һ����ɫ��Ϊ����ɫ |
| �� | ��һ��CuSO4��Һ | ��һ��NaBr��Һ | 75�� | ��Һ����ɫ��Ϊ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
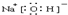
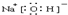
| ||
| ||
 2SO3��g������H=-196.6KJ?mol-1��ƽ��ʱ����������ѹǿΪ��ʹʱ��90%��
2SO3��g������H=-196.6KJ?mol-1��ƽ��ʱ����������ѹǿΪ��ʹʱ��90%���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010���㽭ʡ���ݵ�����У�����߶��ڶ�ѧ�����л�ѧ�Ծ� ���ͣ������
��12�֣��ϳɰ����������Ĵ����������˹��̵���;�����Ի�ѧ��ҵ����Ҳ�������ش�Ӱ�졣�ϳɰ���Ӧ�Ļ�ѧ����ʽΪ��N2(g)��3H2(g) 3NH3(g) ��H����92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2����̼�ڸ�������ˮ������Ӧ�Ƶá��ҹ��ϳɰ���ҵĿǰ����������Ϊ������������ý���¶ȣ�400��500�棬ѹǿ��30��50MPa���ش��������⣺
3NH3(g) ��H����92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2����̼�ڸ�������ˮ������Ӧ�Ƶá��ҹ��ϳɰ���ҵĿǰ����������Ϊ������������ý���¶ȣ�400��500�棬ѹǿ��30��50MPa���ش��������⣺
��1����ˮ����ͨ�����ȵ�̿������ˮú����
C(s) + H2O(g) 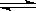 H2(g) + CO(g) ��H =" +131.3" kJ ����S =" +133.7" J/K
H2(g) + CO(g) ��H =" +131.3" kJ ����S =" +133.7" J/K
�÷�Ӧ�ڵ������ܷ��Է� ����ܻ��
��2���ϳɰ���ҵ��ԭ����ѹ����30��50MPa��ԭ���� ����ƽ���ƶ�ԭ������������������ԭ������ת����ʵ�������в���400��500��ĸ��£�ԭ��֮һ�ǿ��ǵ������Ĵ����ԣ�ԭ��֮���� ��
��3����֪��400��ʱ��N2 (g)+ 3H2(g)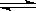 2NH3(g) ��K=0.5��
2NH3(g) ��K=0.5��
����400��ʱ�� 2NH3(g)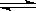 N2 (g)+ 3H2(g)��K= ������ֵ����
N2 (g)+ 3H2(g)��K= ������ֵ����
��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ������
��500�桢50MPaʱ�����ݻ�Ϊ2L�������м���1 mol N2��3mol H2����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱN2��ת����Ϊx����K��x�Ĺ�ϵ����K�� ��
����������ͬ�����и�����1 molN2��3molH2����ijһ��ͬ�����·�Ӧ���ﵽƽ�⣬�������������ʱ��仯��������ͼ������˵����ȷ���� ������ţ���
| A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1 |
| B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P1��P2 |
| C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2 |
| D��ͼ�������ͬ��ͬѹ�£��������ܣ�1��2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com