
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
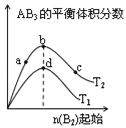
A. 图中T2一定大于T1
B. 图中b点速率一定大于d点速率
C. 达到平衡时,A2的转化率大小为:c>b>a
D. 加入催化剂可以使状态d变为状态b
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂。工业上可先制得高铁酸钠[离子反应为Fe(OH)3+ClO-+OH-→![]() +Cl-+H2O]。然后在高铁酸钠溶液中加入一定量的KOH。可析出高铁酸钾。下列说法不正确的是( )
+Cl-+H2O]。然后在高铁酸钠溶液中加入一定量的KOH。可析出高铁酸钾。下列说法不正确的是( )
A.高铁酸钾能除去水中溶解的H2S等
B.工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子
C.高铁酸钾中Fe为+6价,具有强氧化性,能杀菌消毒
D.高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
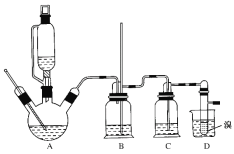
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是________。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____________。
(3)在装置C中应加入NaOH溶液,其目的是_________。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是_______。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用______洗涤除去;若产物中有少量副产物乙醚,可用_____(填操作方法名称)的方法除去。
(6)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰钢是工业上非常重要的一 种合金, 其主要成分锰是用软锰矿(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备的,某种生产工艺流程如下图所示 :
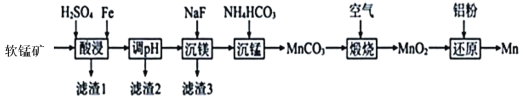
已知:MnO2不溶于稀硫酸,但它可以在酸性条件下和一些还原剂反应生成 Mn2+。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
(1)为了提高锰的浸出率 ,通常需要将软锰矿_______; 酸浸时 MnO2 溶解的离子反应方程式是____________________。
(2)滤渣 2 的主要成分是____________(填化学式)。
(3)沉锰时发生的主要离子反应方程式是________; 沉锰后需要对所得的沉淀进行过滤、洗涤操作,如何检验沉淀己洗净?________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
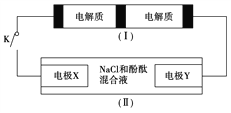
A. 闭合开关K时,Na+从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为3NaBr-2e-===NaBr3+2Na+
C. 闭合开关K时,当有0.1 mol Na+通过离子交换膜时,X电极上放出标准状况下气体1.12 L
D. 闭合开关K时,X电极反应式为2Cl--2e-===Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(HOOC-COOH)是一种常见的有机酸,利用淀粉制备草酸的实验流程如图:
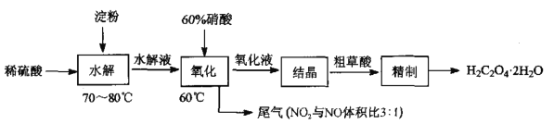
回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是____;“水解”及“氧化”步骤中适宜的加热方式是________________。
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):
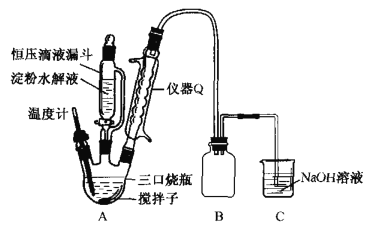
①仪器Q的名称是________.
②三口烧瓶中生成H2C2O4· 2H2O的化学方程式为____________。
③装置B的作用是___________,装置C的作用是_______________。
(3)已知在20℃、70℃时,草酸的溶解度依次为为9. 5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为___________________。
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸_____(填“强”或“弱”)。
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为___________(写结构简式)。
③向K2Cr2O7溶液中加入H2C2 O4·2H2O析出K[Cr(C2O4)2(H2O)2]晶体,该反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
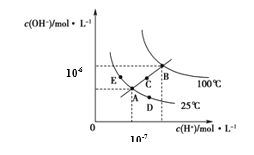
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制备磷酸二氢钾(KH2PO4)装置如图所示。下列说法正确的是
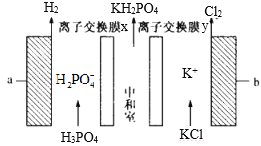
A.与 a 相连接的电源电势比 b 的高
B.离子交换膜 x、y 分别为阳离 子、阴离子交换膜
C.电解时,理论上相同时间内通过交换膜的阴、阳离子数相等
D.当外电路中通过 1mol 电子时,会有ll.2L的Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知水的比热容为4.18×10-3 kJg-1℃-1.10g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O的温度由18℃升至62.4℃,则硫黄的燃烧热为__,热化学方程式为_.
(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下:
2P(s)+3Cl2(g)=2PCl3(g)△H=﹣612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g)△H=﹣798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为___.
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
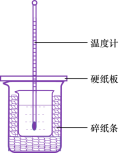
①从实验装置上看,图中尚缺少的一种玻璃用品是____.
②烧杯间填满碎纸条的作用是_.
③大烧杯上如不盖硬纸板,求得的中和热数值_(填“偏大、偏小、无影响”).
④如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热_(填“相等、不相等”).
⑤用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com