
| A. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| B. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
分析 A、Fe元素焰色反应是无色的;
B、明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性;
C、食用植物油的主要成分是高级脂肪酸甘油酯;
D、常温下,铝极易和氧气反应生成氧化铝.
解答 解:A、Fe元素焰色反应呈无色,故A错误;
B、明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性,两者的作用原理不相同,故B错误;
C、食用植物油的主要成分是高级脂肪酸甘油酯,高级脂肪酸甘油酯是人体所需营养物质之一,故C正确;
D、Al属于亲氧元素,常温下,铝极易和氧气反应生成氧化铝从而阻止铝进一步被氧化,故D错误;
故选C.
点评 本题考查学生关注化学与工农业生产、日常生活、社会热点问题,难度不大,注意植物油主要成分是高级脂肪酸甘油酯,汽油是烃.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:解答题

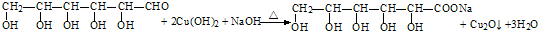
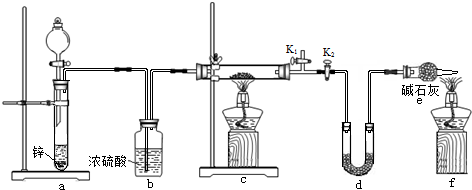
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2YZ3 | B. | XYZ2 | C. | X2YZ2 | D. | XYZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| C. | 在碱性介质中,氢氧燃料电池的负极反应式为:O2+4e-═2O2- | |
| D. | NaHCO3电离:NaHCO3?Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠俗称苏打 | |
| B. | 鉴别Na2CO3和NaHCO3两种无色溶液,可以分别滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| C. | NaHCO3的热稳定性大于Na2CO3 | |
| D. | 向滴有酚酞试剂的水中加入足量的Na2O2粉末并振荡,溶液由无色变红最后又变无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
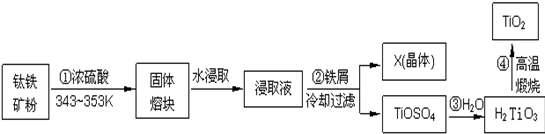
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下均能自发进行 | |
| B. | 原电池工作时所发生的反应一定有氧化还原反应 | |
| C. | 加热时,化学反应只向吸热反应方向进行 | |
| D. | 化学平衡常数的表达式与化学反应方程式的书写无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该浓硝酸中HNO3的物质的量浓度是12.0 mol/L | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | NO2和N2O4的混合气体中,N2O4的体积分数是20% | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com