
分析 纯水在T℃时,pH=6,计算出Kw,1mol•L-1的NaOH溶液中只有水电离出氢离子,所以水电离出的c(OH-)等于溶液中c(H+).
解答 解:纯水在T℃时,pH=6,则水的离子积(KW)=c(OH-).c(H+)=10-6×10-6=10-12,该温度下1mol•L-1的NaOH溶液中c(NaOH)=c(OH-)=1mol/L,该溶液中c(H+)=10-12mol/L,该溶液中只有水电离出氢离子,所以水电离出的c(OH-)等于溶液中c(H+)为10-12mol/L,
故答案为:10-12.
点评 本题考查了pH的有关计算,侧重考查学生分析计算能力,酸、碱抑制水电离,注意:碱中氢离子来源于水的电离,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
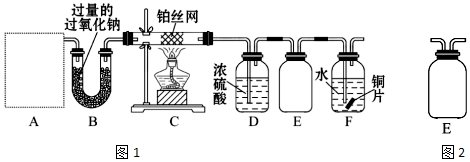
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═HSO3-+NH4+ | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 向含0.1mol•L-1Na2CO3和0.2mol•L-1NaOH的混合溶液中加入等体积的0.15mol•L-1的硫酸:CO32-+3H++2OH-═2H2O+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com