
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是 ( )
A.由Al、Cu、稀H2SO4组成的原电池,负极反应式为Al-3e-===Al3+
B.由Mg、Al、NaOH溶液组成的原电池,负极反应式为Al-3e-+4OH-===
[Al(OH)4]-
C.由Fe、Cu、FeCl3溶液组成的原电池,负极反应式为Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成的原电池,负极反应式为Cu-2e-===Cu2+
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)
(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 |
|
①此温度下该反应的平衡常数K= 。
②已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1
II.CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 
III.2CO(g)+O2(g)=2CO2(g) △H3
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= (用△H1 △H2 △H3表示)。
2CO(g)+2H2(g) 的△H= (用△H1 △H2 △H3表示)。
③对上述反应II:CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO 和 1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副 反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO 和 1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副 反应的影响)。实验条件如下表:
①实验中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,分别画 出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
出实验②和③中c(CO2)随时间变化关系的预期结果示意图。

 (2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生 成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
 (3)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
(3)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
①B极的电极反应式为 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole— 时,实际上消耗的甲醇的质量比理论上大,可能原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关电化学知识的描述正确的是 ( )
A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.原电池的两极一定是由活动性不同的两种金属组成
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在酸性条件下发生的反应为AsO +2I-+2H+===AsO
+2I-+2H+===AsO +I2+H2O,在碱性条件下发生的反应为AsO
+I2+H2O,在碱性条件下发生的反应为AsO +I2+2OH-===AsO
+I2+2OH-===AsO +H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
+H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:

Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现检流计指针均发生偏转。
试回答下列问题:
(1)两次操作中指针为什么发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。
(3)操作Ⅰ过程中C1棒上发生的反应为______________________________________;
(4)操作Ⅱ过程中C2棒上发生的反应为______________________________________。
(5)操作Ⅱ过程中,盐桥中的K+移向______烧杯溶液(填“A”或“B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本 结构如图所示,其中作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出 电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是 ( )

A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是 ( )

A.K+移向催化剂b
B.催化剂a表面发生的化学反应:[Fe(CN)6]4--e-===[Fe(CN)6]3-
C.[Fe(CN)6]3-在催化剂b表面被氧化
D.电解池溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分析如图所示的四个装置,回答下列问题:

①装置a和b中铝电极上的电极反应式分别为_________________________________
________________、__________________________________________________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为________________________________________________________。
(2)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为__________________________________________________、
________________________________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.b电极是负极
B.总反应方程式为:2H2+O2=2H2O
C.负极发生还原反应,正极发生氧化反应
D.氢氧燃料电池是一种具有广泛应用前景的绿色电源
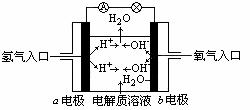
查看答案和解析>>
科目:高中化学 来源: 题型:
对Na、Mg、Al的有关性质的叙述正确的是( )
A.还原性:Na>Mg>Al B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al D.碱性:NaOH<Mg(OH)2<Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com