
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L | |
| C. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1mol Zn,转移的电子总数等于2NA | |
| D. | 5.4g Al分别与含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA |
分析 A、纯水的pH=6,水的离子积为10-12,pH=11的NaOH溶液中氢氧根离子的浓度为0.1mol/L;
B、氢气所处的状态不明确;
C、在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中,锌和NH4NO3做还原剂,硝酸做氧化剂;
D、求出铝的物质的量,然后根据1molAl~3molHCl,1molAl~1molNaOH来分析.
解答 解:A、该温度下水的离子积为10-12,pH=11的NaOH溶液中氢氧根离子的浓度为0.1mol/L,10L该溶液中含有1mol氢氧化钠,含有OH-的数目为NA,故A正确;
B、当导线上流过NA个电子,则正极放出H2的氢气的物质的量为0.5mol,但由于氢气所处的状态不明确,故体积不一定是11.2L,故B错误;
C、在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中,锌和NH4NO3做还原剂,硝酸做氧化剂,故此反应转移5mol电子,溶解1mol锌,故当溶解1mol锌时,转移5mol电子即5NA个,故C错误;
D、5.4g铝的物质的量为0.2mol,而由于1molAl~3molHCl,1molAl~1molNaOH,故0.2mol铝与0.2mol氢氧化钠能恰好完全反应,而与0.2mol盐酸反应时,铝过量,由于反应掉的铝的物质的量不同,故生成的氢气分子个数不同,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Q3-Q2+3 Q1 | B. | Q3+Q2+Q1 | C. | 3Q3-Q2+Q1 | D. | Q2-Q3+3 Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
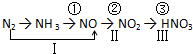
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
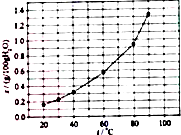
| A. | 溴酸银的溶解是吸热过程 | |
| B. | 温度升高时溴酸银溶解速度加快 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-3 | |
| D. | 若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
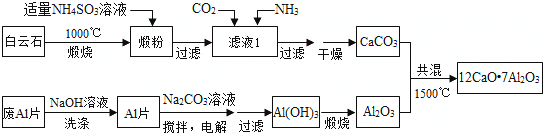
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、MnO4-、Na+、Cl- | B. | K+、Fe2+、NO3-、HCO3- | ||
| C. | Na+、K+、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
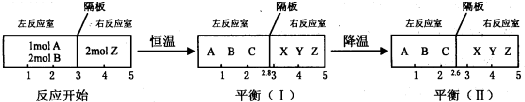
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+3Cl2═2Fe3++Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com