
【题目】下列有关有机化合物的用途及性质的说法正确的是
A.乙烯使酸性KMnO4溶液或溴的CCl4溶液褪色的原理相同
B.苯与液溴在催化剂作用下生成溴苯发生了加成反应
C.淀粉、蛋白质等营养物质在人体内水解生成水和CO2等
D.用K2Cr2O7检验司机是否酒驾利用了乙醇的挥发性和还原性
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )

A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据表格信息,请回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有____(填写字母序号)。
A.缩小反应容器的容积B.扩大反应容器的容积
C.升高温度D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。__________
Ⅱ.25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源。请回答下面与铬有关的一些问题。
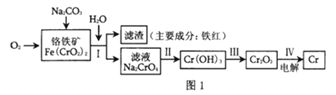
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na2CrO4+6Na2S+23H2O=8Cr(OH)3↓+3Na2S2O3+22NaOH。该反应中氧化剂是___(填化学式),生成1molCr(OH)3时转移电子的物质的量为___mol;
②步骤IV中电解Cr2O3的阳极反应式为___;
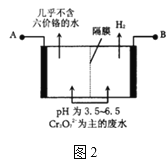
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的___(填“正极”“负极”),阳极区溶液中发生的氧化还原反应为___。
(3)化学需氧量(COD)可量度水体受有机物污染的程度。它是在强酸并加热条件下,用K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量,换算成相当于O2的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取VamL水样于锥形瓶,加入10.00mL0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用cmol/L的硫酸亚铁铵(NH4)2Fe(SO4)2溶液滴定。终点时消耗硫酸亚铁铵溶液VbmL(此步操作的目的是用Fe2+把多余的Cr2O72-反应成Cr3+)。
①Ⅰ中,量取K2Cr2O7溶液的仪器是___;
②Ⅱ中,碎瓷片的作用是___;
③该水样的化学需氧量COD=___(用含c、Va、Vb的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有下列物质:
①HNO3②冰醋酸③氨水④Al(OH)3⑤NaHCO3(s)⑥Cu⑦氯水⑧CaCO3⑨H2CO3⑩盐酸
(1)上述物质中属于强电解质的有__________(填序号),属于弱电解质的有__________(填序号)。
(2)写出下列物质的电离方程式:④__________;⑤__________;⑨__________。
Ⅱ.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的__________(填序号)。
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业、硫酸工业的生产工艺流程大致为:
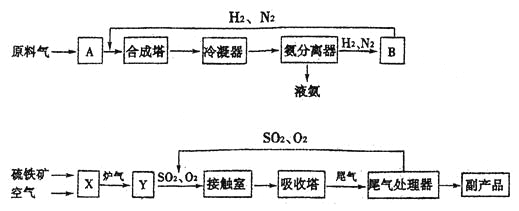
合成塔和接触室中的反应分别为:N2(g)+3H2(g)![]() 2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)![]() 2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)写出流程中设备的名称:B____________,X___________。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是_________________。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是____________(填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是_______________________。
(5)工业生产中常用氨——酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,
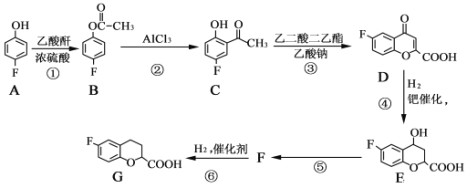
已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)B的分子式为______________,反应①的反应类型为________________
(2)C所含官能团的名称为__________________________________________。
(3)反应⑤的化学方程式为_________________,该反应的反应类型是_________________。
(4)写出满足下列条件的E的同分异构体的结构简式:___________、______________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备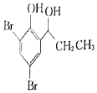 的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OHCH3COOCH2CH3)
CH3CH2OHCH3COOCH2CH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是
A.等物质的量的12CO2与14CO2含有的中子数
B.同温、同压、同体积的CO2和N2O含有的质子数
C.等质量的己烷和丁烷中含有的共用电子对数
D.等物质的量的钠和铁分别与足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com