
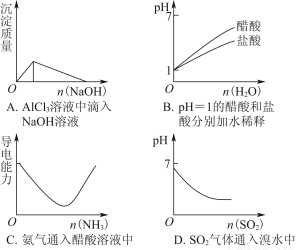
下列实验过程中产生的现象与图中曲线变化相对应的是( )
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:填空题
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备
甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成C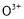 ,然后以C
,然后以C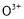 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
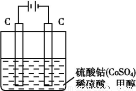
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOClCl)中形成的,其电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S。下列叙述中正确的是( )
A.电解质溶液可以用水,也可以用饱和食盐水
B.电池工作过程中,亚硫酰氯(SOCl2)被还原成Li2SO3
C.电池工作时,锂电极为正极,石墨电极为负极
D.电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
常温下,对下列电解质溶液的有关说法一定正确的是( )
A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH=7
B.在NaHCO3溶液中,c(CO32—)>c(HCO3—)
C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小
D.将pH相等的CH3COONa和Na2CO3溶液稀释相同倍数,CH3COONa溶液的pH较大
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图8-2(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
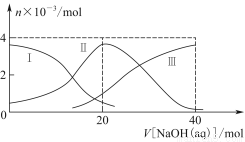
A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.H2A第一步电离的方程式为H2A=HA-+H+
D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
下列事实不能说明醋酸是弱电解质的是( )
A.0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸的pH大
B.醋酸能和碳酸钙反应放出CO2
C.0.1 mol·L-1醋酸钠溶液的pH=8.9
D.大小相同的锌粒分别与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
A.物质A、B的转化率之比为a∶b
B.当v正(A)=2v逆(B)时,可确定反应到达平衡状态
C.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b— )
)
D.若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
正长石的主要成分为硅酸盐,由前20号元素中的4种组成,化学式为XYZ3W8。其中,只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等。Y3+与W的阴离子具有相同的电子层结构。X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是( )
A.X的离子半径>Y的离子半径
B.Z的氢化物的稳定性<W的氢化物的稳定性
C.Y的氧化物既能与盐酸反应,又能与NaOH溶液反应
D.X2W2、Y2W3两种化合物含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:填空题
H是一种人工合成的香料,其合成路线可简单表示如下:
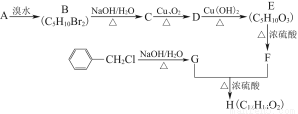
已知A的结构简式为CCH3—CH2CH3CH2,F的分子结构中含有2个甲基。
请回答下列问题:
(1)C中官能团的名称为 ,G的核磁共振氢谱中有 组峰,H的结构简式为 。
(2)写出反应D→E的化学方程式: 。
E在一定条件下生成的高分子化合物的结构简式为 _ _。
(3)写出符合下列条件的F的3种同分异构体的结构简式: 。
①属于酯类 ②含有1个甲基 ③能与溴水发生加成反应 ④能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com