
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
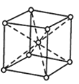
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。
【答案】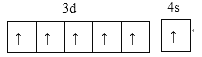 平面三角形 sp2杂化 18NA PCl5
平面三角形 sp2杂化 18NA PCl5 ![]() 体心立方 68
体心立方 68 ![]() a 5a3ρNA×10-22
a 5a3ρNA×10-22
【解析】
A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素为Na元素,B元素3p能级半充满为P元素,C是所在周期电负性最大的元素为Cl元素,D是第四周期未成对电子最多的元素为Cr元素,
(1)D元素为铬元素,能层上为半充满状态时价电子为未成对电子最多;
(2)①依据价电子互斥理论确定硝酸根离子的空间构型,再结合杂化轨道理论判断其中心原子的杂化类型;
②结合物质结构判断含有σ键数;
(3)B、C两种元素分别为P和Cl,形成化合物为:PCl3,PCl5,结构对称的正负电荷重心重合的为非极性分子,结合共价键电子式书写方法解答;
(4)依据金属晶体中金属原子在空间上的堆积模型分析判断;原子的体积占晶胞体积的百分率即空间利用率,结合晶胞结构进行计算;
(5)利用均摊法计算晶胞内原子的个数,再结合晶体的密度 = 晶胞的密度= ![]() 推导出晶体的摩尔质量,其数值即为所求。
推导出晶体的摩尔质量,其数值即为所求。
(1)D元素为铬元素,能层上为半充满状态时价电子为未成对电子最多,其价电子的电子排布图为 ,
,
故答案为: ;
;
(2)①硝酸根离子中价电子对个数=3+![]() (5+1-3×2)=3,且不含孤对电子,所以该分子为平面三角形,中心原子采用sp2杂化;
(5+1-3×2)=3,且不含孤对电子,所以该分子为平面三角形,中心原子采用sp2杂化;
故答案为:平面三角形;sp2杂化;
②在 [D(H2O)6] 3+中配合离子Cr3+与水之间形成的化学键为配位键,配位键是特殊的共价键,属于σ键,所以1 mol [D(H2O)6] 3+中含有σ键有12+6 = 18 mol = 18 NA;
故答案为:18 NA;
(3)B、C两种元素分别为P和Cl,形成化合物为:PCl3,PCl5,其中PCl3为三角锥性结构,属于极性分子,PCl5为三角双锥性结构,属于非极性分子,PCl3电子式为:![]() ;
;
故答案为:PCl5;![]() ;
;
(4)由晶胞结构图可知,该金属原子的晶胞堆积模型为体心立方堆积模型,根据均摊法可知晶胞内所含原子数 = 8×![]() +1= 2,设该晶胞的边长为a cm,原子为等径圆球,其半径为r cm,则结合几何构型可知,等径圆球的半径为该晶胞体对角线的1/4,即a =
+1= 2,设该晶胞的边长为a cm,原子为等径圆球,其半径为r cm,则结合几何构型可知,等径圆球的半径为该晶胞体对角线的1/4,即a = ![]() ,则该晶胞中原子的体积占晶胞体积的百分率为
,则该晶胞中原子的体积占晶胞体积的百分率为![]() =
= ![]() =
= ![]() ×100% =
×100% = ![]() ×3.14×100%
×3.14×100%![]() 68%,
68%,
故答案为:体心立方;68;
(5)E的原子序数比D大3,则E为钴元素,结合E晶体的一种晶胞模型根据均摊法可知晶胞内所含原子数 = 8×![]() +1= 2,则结合几何构型可知,E的原子半径为该晶胞体对角线的1/4 =
+1= 2,则结合几何构型可知,E的原子半径为该晶胞体对角线的1/4 = ![]() a,则该晶胞的质量为
a,则该晶胞的质量为![]() g = ρ g·cm-3×(a×10-7cm) 3,得出M = 5a3ρNA×10-22
g = ρ g·cm-3×(a×10-7cm) 3,得出M = 5a3ρNA×10-22
故答案为:![]() a;5a3ρNA×10-22。
a;5a3ρNA×10-22。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是
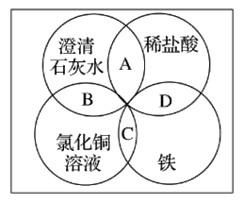
A. 复分解反应、复分解反应、化合反应、置换反应
B. 中和反应、置换反应、复分解反应、置换反应
C. 复分解反应、复分解反应、置换反应、置换反应
D. 分解反应、复分解反应、置换反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 2.3gNa投入到97.7g水中形成溶液的质量分数为2.3%
B. 25g CuSO4.5H2O溶于水配成1L溶液,溶质的物质的量浓度为0.1mol/L
C. Na2O2溶于水后溶质未发生改变
D. 标准状况下,22.4 L的SO3中所含分子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
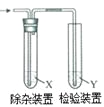
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.石油是混合物,汽油是纯净物
B.沸点:汽油>煤油>柴油
C.直馏汽油和裂化汽油成分完全相同
D.石油分馏是物理过程,石油裂化是化学过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
沸点(℃) | -252.8 | -146 | -103.7 | -47.4 | 80.10 | 110.63 | 4827 |
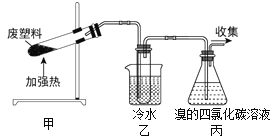
(1)甲试管中最终残留物是_____________。它有多种用途,如下列转化就可制取聚乙炔。写出反应②的化学方程式__________________________ 。
![]()
(2)乙中试管收集到的两种产品中,有一种能使酸性高锰酸钾溶液褪色的物质,该物质为__________。
(3)丙中锥形瓶观察到的现象_____________________________________。反应的化学方程式是__________________________、_________________________。
(4)经溴的四氯化碳溶液充分吸收,最后收集到的气体是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是

A. 第①组反应的氧化产物为O2
B. 第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C. 第③组反应中生成3mol C12,转移6mol电子
D. 氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H2AsO4和单质硫,写出发生反应的化学方程式 _____________________________________________;该反应需要在加压下进行,原因是 _______________________________________
(3)已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4 (s) △H1
H2(g)+1/2O2(g)=H2O(l) △H2
2As(s)+5/2O2(g)=As2O5(s) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4 (s)的△H= ________________________
(4)298K时,将20mL 3xmol·L-1Na3AsO3、20mL 3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
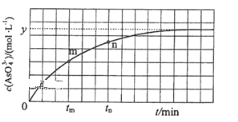
①下列可判断反应达到平衡的是 ______ (填标号).
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时,v正______v逆 ( 填“大于”“小于”或“等于”)
③tm时,v逆 ______tn时v逆(填“大于”“小于”或“等于”),理由是 ____________________
④若平衡时溶液pH=14,则该反应的平衡常数K为 ______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com