
| 实验步骤 | 预期现象和结论 |
| 步骤1: | 火焰呈黄色,证明原溶液中存在Na+. |
| 步骤2: | |
| 步骤3:另取少量原溶液于试管中, | 品红溶液褪色,证明原溶液中存在SO32-. |
| 实验步骤 | 预期现象和结论 |
| 步骤1:用光洁无锈的铁丝蘸取原溶液在酒精灯火焰上灼烧 | 火焰呈黄色,证明原溶液中存在Na+. |
| 步骤2:取少量原溶液于试管中,加入过量CaCl2溶液,充分反应后静置,向上层清夜中滴加几滴酚酞,振荡 | 酚酞变为红色,证明原溶液中存在OH-. |
| 步骤3:另取少量原溶液于试管中,滴入几滴品红溶液,再加入过量稀盐酸,振荡 | 品红溶液褪色,证明原溶液中存在SO32-. |
|
| 0.0014mol |
| 0.01L |
| 0.0006mol |
| 0.01L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、13C与14C互为同位素,化学性质相同,但相对原子质量一定不同 |
| B、某元素原子次外层电子数是最外层电子数的2倍,则该元素氧化物为酸性氧化物 |
| C、IA族元素与VIIA元素形成的化合物都为离子化合物 |
| D、短周期中,同周期元素的离子半径从左到右逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA. |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3P2表示3P能级有两个轨道 |
| B、同一原子中1S、2S、3S电子的能量逐渐降低 |
| C、氢原子电子云的一个小黑点表示一个电子 |
| D、处于最低能量的原子叫基态原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取1mLA溶液于一试管中,加入约2mL的CCl4,充分振荡后静置. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
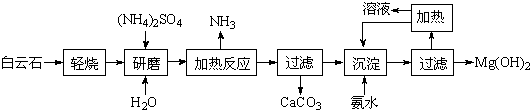
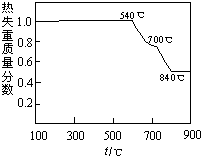
查看答案和解析>>
科目:高中化学 来源: 题型:
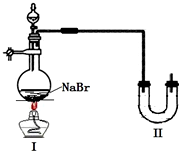 某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
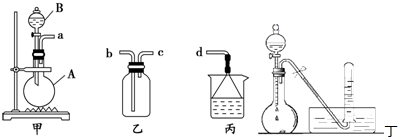
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com