
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO![]() )、c(NO
)、c(NO![]() )和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
)和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
【答案】 略 2.5×10-2 75% > 不变 升高温度 c(NO3-)>c(NO2-)>c(CH3COO-) b、c
【解析】试题分析:本题考查化学平衡常数表达式的书写和影响因素,化学反应速率和化学平衡的计算,外界条件对化学平衡的影响,盐类水解的规律和溶液中离子浓度大小的比较。
(1)由化学平衡常数的概念写出K1=c(ClNO)/c2(NO2),K2=c2(ClNO)/[c2(NO)·c(Cl2)],反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=[ c2(NO)·c(Cl2)]/c4(NO2)=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=[ c2(NO)·c(Cl2)]/c4(NO2)=![]() 。
。
(2)反应起始到平衡时转化的ClNO物质的量为7.5×10-3molL-1min-1![]() 10min
10min![]() 2L=0.15mol,用三段式计算
2L=0.15mol,用三段式计算
2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
n(起始)(mol) 0.2 0.1 0
n(转化)(mol) 0.15 0.075 0.15
n(平衡)(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol。NO的转化率a1=0.15mol![]() 0.2mol=0.75。该反应的正反应为气体分子数减小的反应,该反应若在其他条件不变,恒压条件下进行,相当于在恒容条件下达到平衡后,增大压强,平衡正向移动,平衡时NO的转化率增大,a2
0.2mol=0.75。该反应的正反应为气体分子数减小的反应,该反应若在其他条件不变,恒压条件下进行,相当于在恒容条件下达到平衡后,增大压强,平衡正向移动,平衡时NO的转化率增大,a2![]() a1。平衡常数只与温度有关,温度不变平衡常数不变,K2不变。要使K2减小只能改变温度,由于该反应的正反应为放热反应,所以使K2减小只能升高温度。
a1。平衡常数只与温度有关,温度不变平衡常数不变,K2不变。要使K2减小只能改变温度,由于该反应的正反应为放热反应,所以使K2减小只能升高温度。
(3)根据方程式2NO2+2NaOH=NaNO3+NaNO2+H2O,0.2mol NaOH与0.2mol NO2恰好完全生成0.1molNaNO3和0.1molNaNO2,所得溶液中NaNO3、NaNO2物质的量浓度都为0.1mol/L,NaNO3属于强酸强碱盐不发生水解,NaNO2、CH3COONa都属于强碱弱酸盐,NO2-、CH3COO-都发生水解使溶液呈碱性,则NO3-的浓度最大;HNO2的电离平衡常数大于CH3COOH的电离平衡常数,酸性:HNO2![]() CH3COOH,则CH3COO-的水解能力强于NO2-,两溶液中c(NO3-)、c(NO2-)、c(CH3COO-)由大到小的顺序为c(NO3-) > c(NO2-)> c(CH3COO-)。CH3COO-的水解能力强于NO2-,CH3COONa溶液的碱性大于混合液,溶液A的pH小于溶液B。a项,向溶液A中加适量水,溶液A的pH减小,不能使两者pH相等,错误;b项,向溶液A中加入适量NaOH,溶液A的pH增大,可使两者pH相等,正确;c项,向溶液B中加适量水,溶液B的pH减小,可使两者pH相等,正确;d项,向溶液B中加适量NaOH,溶液B的pH增大,不能使两者pH相等,错误;答案选b、c。
CH3COOH,则CH3COO-的水解能力强于NO2-,两溶液中c(NO3-)、c(NO2-)、c(CH3COO-)由大到小的顺序为c(NO3-) > c(NO2-)> c(CH3COO-)。CH3COO-的水解能力强于NO2-,CH3COONa溶液的碱性大于混合液,溶液A的pH小于溶液B。a项,向溶液A中加适量水,溶液A的pH减小,不能使两者pH相等,错误;b项,向溶液A中加入适量NaOH,溶液A的pH增大,可使两者pH相等,正确;c项,向溶液B中加适量水,溶液B的pH减小,可使两者pH相等,正确;d项,向溶液B中加适量NaOH,溶液B的pH增大,不能使两者pH相等,错误;答案选b、c。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的结构简式为_______。
(2)D分子中最多有_____个碳原子共平面,与D化学式相同且符合下列条件的同分异构体有__种。(①与D具有相同的官能团,②苯环上的三元取代物)
(3)①的反应类型是________。
(4)⑤的化学方程式为________。
(5)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
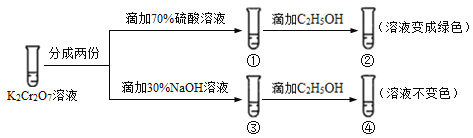
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对含微量![]() 的某样品进行
的某样品进行![]() 化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用
化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用![]() 标准溶液滴定以求得
标准溶液滴定以求得![]() 的浓度。下列分析正确的是
的浓度。下列分析正确的是
已知:![]() 过量
过量![]()
方法一![]() 样品
样品![]()
![]()
![]() -
-![]()
![]()
![]()
![]()
![]()
方法二![]() 样品
样品![]()
![]() I2
I2![]()
![]()
A.方法二对样品所做处理操作简便,用作微量的测定更准确
B.当待测液由无色变为蓝色时即达到滴定终点
C.方法一与方法二测量出的样品浓度比为6:l
D.假设各步骤操作均得当,方法一所消耗![]() 标准溶液的体积是方法二的6倍
标准溶液的体积是方法二的6倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-2×57.3kJ·mol-1
B.101kPa时,H2的热值为142.75kJ·g-1,则表示氢气标准燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
C.由C(金刚石)=C(石墨) ΔH=-1.9kJ·mol-1可知,金刚石比石墨稳定
D.同温同压下,4Al(s)+3O2(g)=2Al2O3(s)在常温和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.3 mol·L-1B.2 mol·L-1C.4 mol·L-1D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:2X(g)+Y(s)![]() Z(g)+W(g),若其化学平衡常数K和温度t的关系如下表
Z(g)+W(g),若其化学平衡常数K和温度t的关系如下表
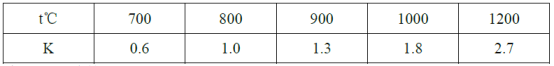
下列叙述不正确的是( )
A.上述反应的正反应是吸热反应
B.该反应的化学平衡常数表达式为K=![]()
C.若在1L的密闭容器中通入X和Y各1mol,5min后温度升高到800℃,此时测得X为0.33mol,该反应达到平衡状态
D.混合气体的密度保持不变可作为该反应达到平衡的标志之一
查看答案和解析>>
科目:高中化学 来源: 题型:
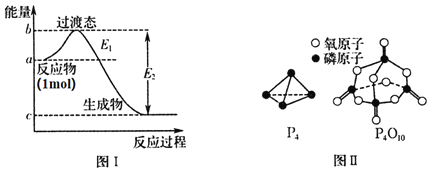
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com