
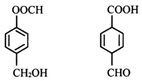
| A. | 均可发生取代、加成反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 分子中共平面的碳原子数相同 | |
| D. | 互为同分异构体,可用NaHCO3溶液鉴别 |
分析 前者含-COOCH、-OH,后者含碳碳双键、-COOH、-OH,结合酯、烯烃、羧酸、醇的性质来解答.
解答 解:A.含-OH、-COOH均可发生取代反应,含苯环、碳碳双键可发生加成反应,故A正确;
B.前者含-OH,后者含-CHO、双键,均能使酸性高锰酸钾溶液褪色,故B正确;
C.苯环为平面结构,前者有8个C原子共面,后者碳碳双键为平面结构,与-CHO、-COOH相连的C为四面体构型,则8个C不可能共面,故C错误;
D.分子式相同、结构不同,互为同分异构体,后者含-COOH,与NaHCO3溶液反应,用NaHCO3溶液鉴别,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意常见有机物性质的应用,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 0.lmol•L-1的HNO2溶液的c(H+)=l0-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.070 | 0.066 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性:X<Y | |
| B. | 原子Z的价电子数为5 | |
| C. | 元素的简单离子半径:r(X2+)>r(W2-) | |
| D. | 元素Y的最高价氧化物对应的水化物能溶于氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 特征信息 |
| A | 有一种原子内只有质子,没有中子 |
| B | L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
| D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
| E | 单质为黄绿色,可用于制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 元素X、Y组成的化合物只有两种 | |
| C. | W的简单气态氢化物的热稳定性比Y的弱 | |
| D. | Q、Z的简单离子具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL0.l mol/LFeCl3溶液中含Fe3+0.05NA | |
| B. | 常温常压下,2.24L氯气溶于NaOH溶液中,转移电子数为0.lNA | |
| C. | 常温常压下,28g乙烯中所含C-H键的数目为4NA | |
| D. | 0.5 mol锌与浓硫酸完全反应生成SO2和H2的混合气体(不考虑气体溶解),气体的分子总数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b极发生还原反应 | |
| B. | a极的电极反应:CH3OH+H2O-6e-═CO2+6H+ | |
| C. | 总反应方程式为:2CO2+4H2O$\frac{\underline{\;通电\;}}{\;}$2CH3OH+3O2 | |
| D. | 该装置将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
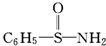 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com