
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量溶液Ⅰ于试管A、B中 | |
| 步骤2: | |
| 步骤3: |
分析 (1)双氧水具有氧化性,能够氧化Na2S2O3,影响碘单质的测定;
(2)双氧水将亚铁离子氧化成铁离子,据此写出反应的离子方程式;
(3)Na2S2O3呈碱性,应该选用碱式滴定管,图示为酸式滴定管;
(4)碘单质遇到淀粉显示蓝色,可以选用淀粉为滴定指示剂;根据反应结束前溶液为蓝色、滴定结束时为无色判断滴定终点的现象;
(5)根据图2中初读数为、末读数计算出滴定过程中消耗Na2S2O3溶液的体积,再根据n=cV计算出消耗硫代硫酸钠的物质的量;根据电子守恒及反应2H++H2O2+2Fe2+=2Fe3++2H2O、I2+2S2O32-═I-+S4O62-可得关系式:2Fe2+~2Fe3+~I2~2S2O32-,根据关系式计算出亚铁离子的物质的量,再计算出溶液中亚铁离子浓度;若滴定前溶液中H2O2没有除尽,由于双氧水能够氧化硫代硫酸钠,则测定的碘单质的物质的量偏大,计算出的亚铁离子的含量偏高;
(6)结合假设1、2可知,假设3为:溶液中可能既含有亚铁离子,也含有铁离子;验证假设3成立,需要分别证明亚铁离子和铁离子,根据二者的检验方法进行解答.
解答 解:(1)由于双氧水具有氧化性,能够氧化Na2S2O3,影响碘单质的测定,双氧水不稳定,加热后能够除去,所以加热煮沸的目的是除去残留的H2O2,防止影响测定,
故答案为:除去残留的H2O2,防止影响测定;
(2)双氧水与亚铁离子反应的离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:2H++H2O2+2Fe2+=2Fe3++2H2O;
(3)Na2S2O3溶液显示碱性,应该使用碱式滴定管盛放,图示滴定管为酸式滴定管,所以不合理,
故答案为:否;
(4)由于碘单质遇到淀粉显示蓝色,故可选用淀粉为滴定指示剂;滴定结束前溶液为蓝色、滴定结束时为无色,则滴定终点的现象为:溶液由蓝色变无色且保持半分钟不变色,
故答案为:淀粉;溶液由蓝色变无色且保持半分钟不变色;
(5)图2中初读数为0.20mL,末读数为20.20mL,则滴定过程中消耗Na2S2O3溶液的体积为:20.20mL-0.20mL=20.00mL,含有硫代硫酸钠的物质的量为:0.1 000mol•L-1×0.02L=0.002mol,
根据电子守恒及反应2H++H2O2+2Fe2+=2Fe3++2H2O、I2+2S2O32-═I-+S4O62-可得关系式:2Fe2+~2Fe3+~I2~2S2O32-,则20.00mL溶液Ⅰ中含有亚铁离子的物质的量为:n(Fe2+)=n(S2O32-)=0.002mol,
所以溶液Ⅰ中铁元素的总含量为:$\frac{56g/mol×0.002mol}{0.02L}$=5.6g/L;
若滴定前溶液中H2O2没有除尽,双氧水能够氧化硫代硫酸钠,则测定的碘单质的物质的量偏大,所测定的铁元素的含量将会偏高,
故答案为:5.6;偏高;
(6)根据假设1:溶液Ⅰ中只存在Fe2+、假设2:溶液Ⅰ中只存在Fe3+可知,溶液中可能同时存在铁离子和亚铁离子,故假设3为:溶液Ⅰ中存在Fe2+和Fe3+;
验证假设3成立,需要分别检验Fe2+和Fe3+同时存在,具体操作方法和步骤为:取少量溶液Ⅰ于试管A、B中,往试管A中滴入2~3滴淀粉-KI溶液,振荡,溶液变蓝色,证明溶液Ⅰ中含有Fe3+;往试管B加入3moL•L-1H2SO4酸化,再滴入2~3滴KMnO4溶液,振荡,若溶液颜色从深紫色变成黄色或变浅,则含有Fe2+(或加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+)结合步骤2可知假设3成立,
故答案为:溶液Ⅰ中存在Fe2+和Fe3+;
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量溶液Ⅰ于试管A、B中 | - |
| 步骤2: | 往试管A中滴入2~3滴淀粉-KI溶液,振荡,观察变化;溶液变蓝色,证明溶液Ⅰ中含有Fe3+; |
| 步骤3: | 往试管B加入3moL•L-1H2SO4酸化,再滴入2~3滴KMnO4溶液,振荡,观察变化; 溶液颜色从深紫色变成黄色或变浅,则含有Fe2+(或加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+)结合步骤2,则假设3成立 |
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度较大,涉及铁离子、亚铁离子的检验、离子方程式书写、中和滴定操作方法及计算等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol NH3中含有3NA个N-H键 | |
| B. | 36g C60含分子数为0.05NA | |
| C. | 标准状况下,11.2L CO2中含有2NA个共用电子对 | |
| D. | 18g重水(${\;}_{1}^{2}$H2O)中含有10NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
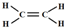
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NH4+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | K+、Na+、SO42-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
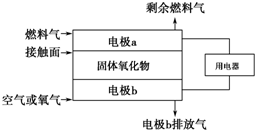 以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )| A. | 该电池工作时的总反应式为4NH3+5O2═4NO+6H2O | |
| B. | 电池工作时,接触面上的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 固体氧化物作为电池工作时的电解质,其作用是让电子在电池内部移动 | |
| D. | 外电路的电流方向为从电极a流向电极b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com