
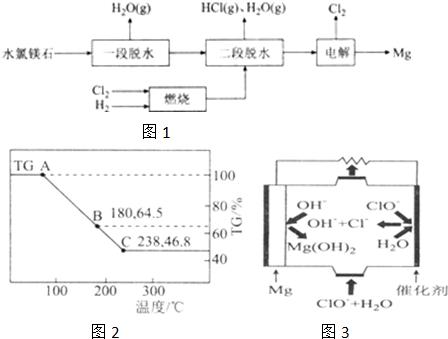
分析 (1)依据热化学方程式①Mg(s)+H2(g)=MgH2(S)△H1=-74.5kJ•mol-1;②Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-l,利用盖斯定律将②-2×①得到反应Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s),进而计算反应热;
(2)①图中AB线段为“一段脱水”,设B点对应固体物质的化学式为MgCl2•xH2O,根据$\frac{18x+95}{6×18+95}$=0.645,可计算确定B的化学式;二段脱水中通入HCl可以抑制MgCl2的水解;
②制备金属镁工艺的关键流程分析,循环使用的物质是加入后在反应过程中有重新生成分析判断;
(3)根据化合价代数和为0判断镁的化合价,根据元素守恒书写化学方程式;
(4)根据氧化还原反应Mg(AIH4)2=MgH2+2Al+3H2↑中电子转移数目与产物的物质的关系进行计算;
(5)依据“镁-次氯酸盐”燃料电池的装置图中所示,原电池的正极应发生还原反应,元素的化合价降低,根据图示可知,正极上是ClO-变为Cl-,据此写出正极反应式.
解答 解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6KJ/mol,则△H3=+84.6KJ/mol,
故答案为:+84.6KJ/mol;
(2)①图中AB线段为“一段脱水”,设B点对应固体物质的化学式为MgCl2•xH2O,根据$\frac{18x+95}{6×18+95}$=0.645,计算得 x=2,所以B的化学式为MgCl2•2H2O;二段脱水中通入HCl可以抑制MgCl2的水解,
故答案为:MgCl2•2H2O;为防止MgCl2•2H2O脱水过程中发生水解反应;
②制备金属镁工艺的关键流程分析,循环使用的物质是加入后在反应过程中有重新生成的物质,分析可知是氯气和氯化氢,
故答案为:HCl,Cl2;
(3)根据CH3MgCl中各元素化合价代数和为0可知镁的化合价为+2价,CH3MgCl水解时生成甲烷、氯化镁和氢氧化镁,反应的化学方程式为2CH3MgCl+2H2O=Mg(OH)2+MgCl2+2CH4↑,
故答案为:+2;2CH3MgCl+2H2O=Mg(OH)2+MgCl2+2CH4↑;
(4)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,所以每转移3mol电子生成Al的物质的量为1mol,即质量为27g,
故答案为:27g;
(5)“镁-次氯酸盐”燃料电池的装置图中微粒变化分析可知,ClO-在正极放电,生成Cl-,结合碱性的环境,可写出正极反应式:ClO-+2e-+H2O=Cl-+2OH-,
故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评 本题考查了热化学方程式书写方法,物质制备实验的分析判断,原电池原理和电极原理的分析应用,图象分析能力,掌握基础知识是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在某溶液中先加HNO3,无明显现象,再加入AgNO3溶液有白色沉淀产生,且沉淀不消失,则该溶液中一定有Cl- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 做焰色反应前应先将铂丝在稀硫酸中洗干净再蘸取待测液进行实验 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸溶液于氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ag+、HCO3-、Cl- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | Ba2+、K+、Fe3+、Cl- | D. | K+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
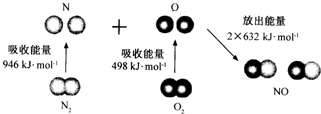
| A. | N2 (g)和O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 molO原子结合生成O2(g)时需要吸收498kJ能量 | |
| C. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444kJ•mol-1 | |
| D. | 1molNO(g)分子中的化学键断裂时需要吸收632kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
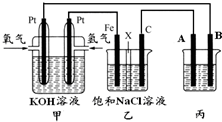 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和电镀的原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和电镀的原理,其中乙装置中X为阳离子交换膜.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人工合成青蒿素经过了长期的实验研究,实验是化学研究的重要手段 | |
| B. | 从青蒿中提取青蒿素的方法是以萃取原理为基础,萃取是一种物理变化 | |
| C. | 可以用苯把溶解在乙醇中的青蒿素萃取出来,静置分层后,下层为苯的青蒿素溶液 | |
| D. | 现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com