
在口KClO3+口HCl(浓)=口KCl+口Cl2↑+口H2O的反应中,
(1)配平该化学方程式,各物质前化学计量数分别是 , , , , .
(2)写出该反应的离子方程式 .
(3)若有7.3gHCl被氧化,则有 molCl2生成.
(4)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是
A、3Cl2+6FeI2=2FeCl3+4FeI3 B、Cl2+FeI2=FeCl2+I2
C、Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D、2Fe3++2I﹣=2Fe2++I2.
考点:
氧化还原反应方程式的配平;氧化性、还原性强弱的比较;氧化还原反应的计算.
专题:
氧化还原反应专题.
分析:
(1)KClO3中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由﹣1价升高到0,根据电子守恒及质量守恒定律来配平;
(2)根据离子方程式的书写规则书写,注意气体、弱电解质要写化学式;
(3)根据被氧化的氯化氢和氯气之间的关系式计算;
(4)在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断.
解答:
解:(1)在KClO3+HCl(浓)→KCl+Cl2↑+H2O中,KClO3中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由﹣1价升高到0,由电子守恒及质量守恒定律可知,配平后的化学反应为KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,故答案为:1,6,1,3,3.
(2)根据离子方程式的书写规则知,该离子方程式为:5Cl﹣+6H++ClO3﹣=3Cl2↑+3H2O,故答案为:5Cl﹣+6H++ClO3﹣=3Cl2↑+3H2O;
(3)根据5Cl﹣+6H++ClO3﹣=3Cl2↑+3H2O知,被氧化的氯化氢与生成氯气的物质的量之比=5:3,所以7.3gHCl被氧化生成氯气的物质的量=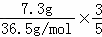 =0.12mol,故答案为:0.12;
=0.12mol,故答案为:0.12;
(4)Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,
A、因为氧化性FeCl3>I2,所以氯气先氧化碘离子后氧化铁离子,故A错误;
B、因为氧化性FeCl3>I2,所以氯气先氧化碘离子后氧化铁离子,故B正确;
C、因为氧化性Co2O3>Cl2,所以Co2O3+6HCl=2CoCl2+Cl2↑+3H2O能发生,故C正确;
D、因为氧化性FeCl3>I2,所以2Fe3++2I﹣=2Fe2++I2能发生,故D正确;
故选A.
点评:
本题考查氧化还原反应的配平、氧化性强弱的比较等知识点,根据得失电子数相等及原子守恒配平即可,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
保护环境是每一个公民的责任,下列做法有利于保护环境的是( )
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理 ③推广使用一次性木质筷子 ④推广使用清洁能源 ⑤过量使用化肥、农药 ⑥推广使用无氟冰箱.
A. ①②④⑤ B. ②③④⑥ C. ①②④⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)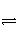
 qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验描述,符合事实的是( )
|
| A. | 金属钠暴露在空气中,表面变暗,生成淡黄色固体氧化钠 |
|
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量的热,产生白色固体 |
|
| C. | 用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热 |
|
| D. | 用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应3Cu+8HNO3(稀)═Cu(NO3)2+2NO↑+4H2O.当生成2molNO时,下列说法正确的是( )
|
| A. | 有2molHNO3被还原 | B. | 转移的电子数目为6mol |
|
| C. | 有8molHNO3参加反应 | D. | HNO3只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不大于100 kJ·mol-1
D.正反应活化能比逆反应活化能大100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-Q1 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH2=-Q2 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH3=-Q3 kJ·mol-1
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.05Q3 B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3 D.0.4Q1+0.2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
下面关于化学反应的限度的叙述中,正确的是( )
A. 化学反应的限度都相同
B. 可以通过改变温度控制化学反应的限度
C. 可以通过延长化学反应的时间改变化学反应的限度
D. 当一个化学反应在一定条件下达到限度时,反应即停止
查看答案和解析>>
科目:高中化学 来源: 题型:
化学就是在原子、分子水平上研究物质的( )
①组成 ②结构 ③性质 ④变化 ⑤制备 ⑥应用.
A.①②③④ B.①③⑤ C.②④⑥ D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com