
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+2H+═Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu═Fe2++Cu2+ | 正确 |
| D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | 错误,HCO3-也可以与OH-反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁与盐酸反应生成亚铁离子,不是生成铁离子;
B.大理石和醋酸都需要保留化学式;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.氢氧化钠过量,碳酸氢根离子也参与反应.
解答 解:A.铁与稀盐酸反应生成氯化亚铁,正确的离子方程式为:Fe+2H+═Fe2++H2↑,提供的离子方程式错误,评价不合理,故A错误;
B.大理石溶于醋酸的反应,碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,题中评价不合理,故B错误;
C.FeCl3溶液“腐蚀”铜箔,二者反应生成氯化亚铁和硫化铜,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,题中离子方程式错误,评价不合理,故C错误;
D.NH4HCO3溶液与过量KOH浓溶液共热,氢氧化钾过量,题中漏掉了碳酸氢根离子的反应,正确的离子方程式为:2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,该评价合理,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,本题解答的关键是判断评价是否合理,不是判断离子方程式是否正确,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 增加SO2的浓度 | B. | 充入一定量惰性气体 | ||
| C. | 升高温度 | D. | 使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
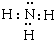 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
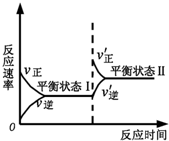
| A. | 反应达平衡时,正反应速率和逆反应速率相等 | |
| B. | 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| C. | 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| D. | 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2LpH=12的氨水中含有OH-数目为0.02NA | |
| B. | 氯碱工业中,外电路中转移电子数为0.3NA时产生气体体积(标准状况)为4.48L | |
| C. | 标准状况下,11.2LCH3Cl中非极性共价键数目等于2.0NA | |
| D. | 一定条件下,1molI2和0.2molH2混合充分反应,转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化学实验中需要用温度计的有石油分馏、硝基苯的制备和乙烯的制取 | |
| B. | 用溴水可以鉴别苯酚溶液、甲苯、乙醇和苯乙烯 | |
| C. | 用酒精可以处理粘在皮肤上的苯酚或苯酚醛树脂制备实验后的试管 | |
| D. | 取适量卤代烃水解后产物,直接滴加AgNO3溶液以确定卤原子种类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com