
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
 (1分)
(1分) 

 +6×
+6×
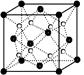
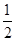 =4,白色球数目=8,故白色球为Na+离子、黑色球为O2-,以晶胞中上面心O2-离子为研究对象,距一个O2-周围最近的Na+离子有8个,位于晶胞中上层4个Na+及上面晶胞中的下层4个Na+,8个Na+离子构成的几何体中每个都是正方形,形成立方体结构;
=4,白色球数目=8,故白色球为Na+离子、黑色球为O2-,以晶胞中上面心O2-离子为研究对象,距一个O2-周围最近的Na+离子有8个,位于晶胞中上层4个Na+及上面晶胞中的下层4个Na+,8个Na+离子构成的几何体中每个都是正方形,形成立方体结构;
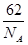
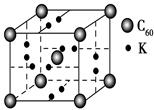
 g,该晶胞的密度为ρ g?cm-3,则晶胞边长a=
g,该晶胞的密度为ρ g?cm-3,则晶胞边长a=



科目:高中化学 来源:不详 题型:问答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沸点:H2O>H2S>H2Se>H2Te | B.稳定性:SiH4>PH3>H2S >HCl |
| C.熔点:SiC >KCl> I2>CO2 | D.沸点:CH4 >SiH4>GeH4>SnH4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
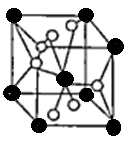
 则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
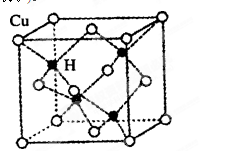
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
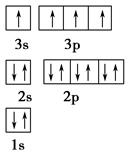
| 离能(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com