

分析 (一) (1)仪器a的名称为分液漏斗;仪器b中碳与浓硫酸加热反应生成二氧化碳、二氧化硫和水;
(2)A中品红溶液用于检验混合气体中含有二氧化硫,B、C装置分别除去并检验二氧化硫已经除尽,D中盛放澄清石灰水,用于检验二氧化碳气体;
(二)要验证铜与稀硝酸反应生成一氧化氮,则应将装置中的O2排出.当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,但由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深;随着反应的不断进行,E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解.D装置用来吸收尾气,防止污染环境,据此进行解答.
解答 解:(一) (1)根据图示可知,仪器a为分液漏斗;仪器b中碳与浓硫酸加热反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:分液漏斗;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)根据图示装置及实验目的可知,要检验二氧化硫和二氧化碳气体,应该先用品红溶液检验二氧化硫,然后用酸性高锰酸钾溶液除去二氧化硫,再用品红溶液检验二氧化硫已经除尽,最后用澄清石灰水检验二氧化碳,所以装置A的作用是检验二氧化硫,装置D中澄清石灰水变浑浊证明产物中含有二氧化碳气体,
故答案为:检验SO2;澄清石灰水变混浊;
(二)(1)当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,以防止氧化生成的NO,
故答案为:产生二氧化碳,排出装置中的空气;
(2)由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深,
故答案为:二氧化碳密度大于空气,未能排尽烧瓶中的空气,少量NO与空气中的氧气反应生成少量的红棕色的NO2;鼓入空气后,NO与氧气反应,生成大量的红棕色气体二氧化氮;
(3)E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解,
故答案为:二氧化氮与水反应生成硝酸,硝酸使白色沉淀碳酸钙溶解;
(4)D装置用来吸收尾气,防止污染环境,
故答案为:吸收尾气,防止污染大气.
点评 本题综合考查物质的性质实验探究,题目难度中等,涉及碳与浓硝酸、铜与稀硝酸的反应以及常见气体的性质及检验方法,侧重于学生的分析能力和实验能力的考查,为高考常见题型.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:填空题
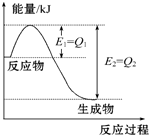 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 | B. | SO2 | C. | O2和SO2 | D. | O2、SO2和SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24L Cl2含孤电子对的数目为0.2NA | |
| C. | pH=2的H2SO4溶液中含H+的数目为0.1NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,甲酸溶液比盐酸溶液的导电性弱 | |
| B. | 甲酸能与NaHCO3作用放出CO2气体 | |
| C. | 等体积、等物质的量浓度甲酸溶液与NaOH溶液混合时恰好完全中和 | |
| D. | 室温下,1mol/L的甲酸溶液的pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用新制氢氧化铜悬浊液可以鉴别有机物中是否含醛基 | |
| B. | 所有的醇都可以发生消去反应生成烯烃 | |
| C. | 羧酸不一定可以与碳酸钠溶液反应 | |
| D. | 苯酚的酸性很弱,不能使指示剂变色,但可以和碳酸氢钠溶液反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.3 mol•L-1 | B. | c(Y2)=0.35 mol•L-1 | ||
| C. | c(X2)=0.15 mol•L-1 | D. | c(Z)=0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com