
| A. | 光化学烟雾是氮氧化物受紫外线照射后与空气中的一些碳氢化合物作用后生成的一种有毒烟雾 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 航天飞机上使用的隔热陶瓷瓦,大多是以碳纤维做增强体的新型复合材料 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
分析 A、光化学烟雾是氮氧化物受紫外线照射后与空气中的碳氢化合物作用后形成的有毒烟雾;
B、酿酒的变化过程为淀粉到葡萄糖到乙醇;
C、陶瓷瓦属于新型复合材料;
D、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染.
解答 解:A、氮氧化物受紫外线照射后与空气中的碳氢化合物作用后形成的有毒烟雾为光化学烟雾,是污染空气的有毒气体,故A正确;
B、以粮食为原料酿酒过程的变化包括粮食提取淀粉,淀粉水解生成葡萄糖,葡萄糖在酒化酶作用下反应生成乙醇,酿酒的变化过程为淀粉到葡萄糖到乙醇,故B正确;
C、航天飞机上使用的隔热陶瓷瓦,大多是以碳纤维做增强体,所以陶瓷瓦属于新型复合材料,故C正确;
D、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,而不能污染后再治理,故D错误;
故选D.
点评 本题考查了化学污染,化学制备原理,化学材料的分析应用,掌握基础是关键,注意积累化学知识,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入少量的NaHSO4溶液中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | SO2通入NaCO溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 用H2O2从酸化的海带灰浸出液中提取I2:H2O2+2I-=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
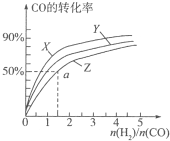 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验表面实验室可用氨水洗涤银镜反应后的试管 | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| D. | 由资料信息科推知:加浓硝酸后生成的沉淀为AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 除⑤外 | C. | 除①外 | D. | 除①、⑤外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量增加 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 相关信息 | 短周期p区元素,有种单质常作电极材料 | 基态原子2p能级上各轨道中均有电子且电子的自旋方向相同 | 基态原子的核外电子共有17种运动状态 | 位于第四周期第VA族 |
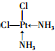 (YH3作为一个整体写)
(YH3作为一个整体写)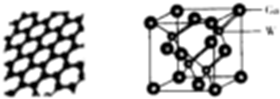
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com