
【题目】下列水解反应离子方程式书写正确的是( )
A.CH3COOH+OH﹣CH3COO﹣+H2O
B.S2﹣+2H2OH2S+2OH﹣
C.CH3COOH+H2OCH3COO﹣+H3O+
D.CO32﹣+H2OHCO3﹣+OH﹣
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅(2814Si)原子中,电子占据的最高能层的轨道数有______个。
(2)已知:蓝色晶体(CuSO4·5H2O)![]() 天蓝色溶液
天蓝色溶液![]() 深蓝色溶液
深蓝色溶液![]() 深蓝色晶体
深蓝色晶体
①蓝色晶体中阴离子的空间构型是_________;
②天蓝色溶液中的阳离子是_____,其配体中心原子的杂化轨道类型是________;
③24.6g深蓝色晶体(其摩尔质量为246g.mol-1)中配离子含有的σ键数是_____;
④实验测得无水乙醇易溶于水,其原因是______________。
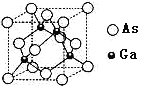
(3)砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料。
①砷化镓属于________晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_____(填化学式),其理由是_________。上述两种晶体中的四种元素电负性最小的是_______(填元素符号)。
②砷化镓晶胞结构如图所示。其晶胞边长为a pm,密度为_______g.cm-3。(砷化镓的摩尔质量为M g.mol-1,阿伏伽德罗常数为NA)
【答案】 9 四面体 [Cu(H2O)4]2+ sp3 1.6NA 乙醇分子与水分子间存在氢键,乙醇分子和水分子都是极性分子 原子晶体 BN 二者均为原子晶体,B、N间的键长比Ga、As的键长短,键能大 Ga 4Mx1030/a3NA
【解析】(1)基态硅(2814Si)原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9;(2)①蓝色晶体CuSO4·5H2O中阴离子SO42-,根据价层电子对互斥理论,价层电子对个数=σ键+孤电子对个数,SO42-中中心原子S的价层电子对为![]() =4,孤电子对数为
=4,孤电子对数为![]() =0,不含孤电子对,所以空间构型是正四面体结构;②蓝色晶体溶于水得到天蓝色溶液中的阳离子是[Cu(H2O)4]2+;其配体H2O中心原子O原子杂化轨道数为
=0,不含孤电子对,所以空间构型是正四面体结构;②蓝色晶体溶于水得到天蓝色溶液中的阳离子是[Cu(H2O)4]2+;其配体H2O中心原子O原子杂化轨道数为![]() =4,,采取sp3杂化方式;③每个配离子[Cu(NH3)4]2+含有的σ键数是3×4+4=16,故24.6g深蓝色晶体{[Cu(NH3)4]SO4H2O }为0.1mol,其中配离子[Cu(NH3)4]2+含有的σ键数是0.1mol×16×NA mol-1=1.6NA;④乙醇分子与水分子间存在氢键,乙醇分子和水分子都是极性分子,故无水乙醇易溶于水;(3)①砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料,与晶体硅相似,故砷化镓属于原子晶体;氮化硼与砷化镓都属于原子晶体,B、N间的键长比Ga、As的键长短,键能大,故BN晶体熔点较高;非金属性越强,电负性越强,则B、N、Ga、As四种元素电负性最小的Ga;②一个晶胞中含有As 8×
=4,,采取sp3杂化方式;③每个配离子[Cu(NH3)4]2+含有的σ键数是3×4+4=16,故24.6g深蓝色晶体{[Cu(NH3)4]SO4H2O }为0.1mol,其中配离子[Cu(NH3)4]2+含有的σ键数是0.1mol×16×NA mol-1=1.6NA;④乙醇分子与水分子间存在氢键,乙醇分子和水分子都是极性分子,故无水乙醇易溶于水;(3)①砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料,与晶体硅相似,故砷化镓属于原子晶体;氮化硼与砷化镓都属于原子晶体,B、N间的键长比Ga、As的键长短,键能大,故BN晶体熔点较高;非金属性越强,电负性越强,则B、N、Ga、As四种元素电负性最小的Ga;②一个晶胞中含有As 8×![]() +6×
+6×![]() =4个,Ga在内部,共4个,即一个晶胞中含有4个砷化镓,其晶胞边长为apm=a×10-10cm,V=a3×10-30cm3,密度为
=4个,Ga在内部,共4个,即一个晶胞中含有4个砷化镓,其晶胞边长为apm=a×10-10cm,V=a3×10-30cm3,密度为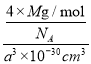 =
=![]() 。
。
点睛:本题考查了方程式的书写、分子空间构型以及杂化类型的判断、晶胞密度计算等知识,题目难度较大,注意相关基础的把握和方法的积累。先根据分摊法计算每个晶胞含有多少个原子,再根据晶胞的边长,确定晶胞的体积,再根据ρ=![]() 计算密度。
计算密度。
【题型】综合题
【结束】
12
【题目】【化学—选修5:有机化学基础】PVB是重要的建筑材料。其合成路线如下(部分反应条件和产物略去)。
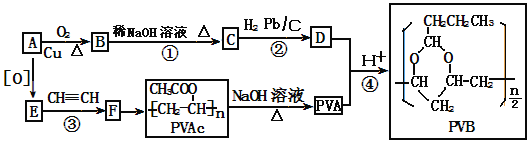
已知:
Ⅰ.A分子式为C2H6O,其核磁共振氢谱图显示有三个波峰。
![]()
Ⅲ. ![]()
回答下列问题:
(1)A的结构简式_______,B→C的反应类型有加成反应和_______,D的官能团为_______。
(2)PVAC的名称是___________(3)C分子中最多有_____个原子共平面。
(3)E→F的反应方程式为_____________。
(4)已知-OH直接连在不饱和C原子上不稳定,会自动发生分子内重排形成-CHO。则D的同分异构体中能与金属Na反应产生H2的有____种。
(5)以溴乙烷为原料制备丁醛(其他无机试剂任选),其流程图为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),
下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池工作时,电子由负极通过外电路流向正极
C. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D. 外电路中每通过0.4mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池的结构示意图,下列说法中,错误的是( ) 
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: .
(2)工业上用Na2SO3溶液吸收烟气中的SO2 . 将烟气通入1.0molL﹣1的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂. ①此时溶液中c(SO32﹣)的浓度是0.2molL﹣1 , 则溶液中c(HSO3﹣)是molL﹣1 .
②向pH约为6的吸收剂中通入足量的O2 , 可将其中的NaHSO3转化为两种物质,反应的化学方程式是 .
③某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示.则: , 有利于提高SO2的吸收效率.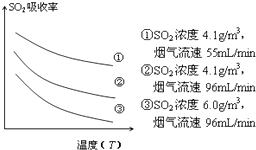
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下: 步骤i称取样品1.000g.
步骤ii将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤iii移取25.00mL样品溶液于250mL锥形瓶中,用0.01000molL﹣1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
①写出步骤iii所发生反应的离子方程式;
②在配制0.01000molL﹣1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量(填“偏大”、“偏小”或“无影响”).
③某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是(填字母).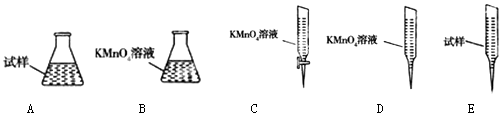
④滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________。
②在[Cu(NH3)4]SO4中,Cu2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_________。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_________。但NF3不易与Cu2+形成化学键,其原因是_______________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为__________。
②已知该晶胞中两个Ba2+的间距为cpm.则距离Ba2+最近的Hg+数目为_____个,二者的最短距离为_______pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
A.常温常压下,22.4 L乙烯中含C﹣H键的数目为4NA
B.1molFe与足量盐酸反应转移电子数为3NA
C.1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为0.1NA
D.向1L 1 molL﹣1氯化铝溶液中加入足量的氨水,生成AlO2﹣的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物之一,为探究SO2气体的性质,某实验小组利用如图1所示装置进行实验。
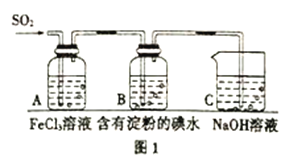
(1)装置A中发生反应的离子方程式为:______________;
(2)装置C的作用是:______________;
(3)在上述装置中通入过量的SO2,为了验证A 中SO2 与Fe3+发生了氧化还原反应,取A 中的溶液少 量,分成两份,并设计了如下实验方案:
方案①:向第一份溶液中加入少量酸性KMnO4溶液,发现紫红色褪去;
方案②,向第二份溶液中加入少量KSCN 溶液,发现不变红,再加入少量新制的氯水,深液变红;
上述方案中不合理的是:________,原因是: ________________;
(4)能表明I-的还原性弱于SO2 的现象是: ________________;
(5)设计实验验证反应结束后A 装置中的Cl-:________________;
(6) 该小组同学设计实验模报测定硫酸工业生产排放的尾气中SO2的体积分数(其他气体均难溶于水且不发生任何反应),选用了如图2所示的简易实验装置。
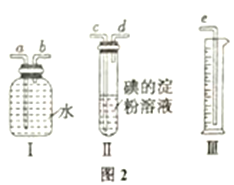
①若混合气体的流向按从左向右时,右图装置组装连接的顺序合理的是:混合气体→A (填写a、b等仪器接口字母)。___________
②你认为下列试剂中,可以用来代替试管中碘的淀粉溶液的是:______ (填标号);
A.酸性KMnO4溶液 B.NaOH 溶液 C.溴水 D.氨水
③若碘溶液的浓度为0.05 mol/L、体积为30 mL,与SO2气体恰好完全反应时,量简内水的体积为386.4 mL(已折算为标准状况下的体积)。则SO2的体积分数为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
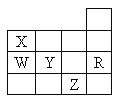
A. 常温常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子相同
C. W的氢化物的热稳定性比X的氢化物的热稳定性高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com