
分析 1mol分子组成为C3H8O的液体有机物A,根据其碳氢关系可知,A为饱和结构,与足量的金属钠作用,可生成11.2L氢气(标准状况),即0.5mol氢气,所以A中有1个羟基,A中的官能团均在碳链的末端,则A为CH3CH2CH2OH,A与足量氧化铜共热,可生成B为CH3CH2CHO.
解答 解:由题意知1molA生成0.5mol氢气,那么A中含有1个羟基,若在链端,应为丙醇,丙醇被氧化生成丙醛,
故答案为:1;羟基;CH3CH2CH2OH;CH3CH2CHO.
点评 本题考查有机物的推断,题目难度中等,注意根据有机物的化学式以及相关性质进行推断,注意了解有机物发生氧化还原反应的特点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>R>T | |
| B. | 气态氢化物的稳定性:W<R<T | |
| C. | 最高价氧化物对应的水化物的碱性:X>Z | |
| D. | XR2、WR2两种化合物中R的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2通入含有1 mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| B. | 用两根铜棒作电极电解盐酸:2H-+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
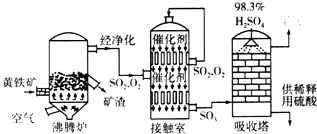
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
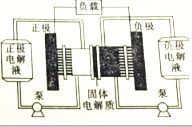 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )| A. | 该电池应该在负极通入空气 | |
| B. | 放电时,Li+透过固体电解质向负极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+2e-═2Cu+O2- | |
| D. | 整个反应过程中,铜相当于催化剂,氧化剂实质是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCnH2n+2中含有的C-C键数为(n-1)NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: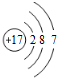 | |
| C. | 氯分子的电子式: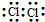 | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com