
| 元素 | 元素的性质、用途或原子结构信息 |
| Q | 原子核外有6个电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液常用作肥料,呈弱碱性 |
| Y | 第三周期元素的简单阴离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
| ||
| ||
| ||
| 1.4g |
| 28g/mol |
| 1.6g |
| 32g/mol |
| 28g/mol×1mol |
| 1.4g |
| 1 |
| 2 |
| 1 |
| 2 |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
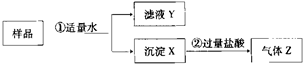
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、C两元素处在元素周期表中的第ⅥA族 |
| B、C、D两种元素的最高价氧化物的水化物相互能够反应生成一种强电解质 |
| C、B、D两元素组成的化合物中阴、阳离子的个数比为1:1 |
| D、B、C、D三种元素的简单离子的半径大小顺序为:C>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、Z单质的熔点是四种单质中最低的 |
| B、Y的最高价氧化物的水化物酸性最强 |
| C、碳元素可与W形成直线型分子 |
| D、ZY4是由极性键形成的极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B、加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C、加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D、加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①②④ |
| C、①②④⑤ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com