
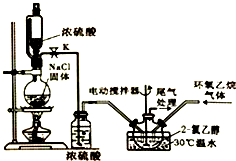
 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.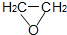 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
分析 本题是利用浓硫酸和氯化钠固体混合加热制取氯化氢,再将环氧乙烷与氯化氢在低温下,发生加成反应生成2-氯乙醇,并根据沸点差异,将反应后的混合利用减压蒸馏的方式分离提纯得到2-氯乙醇;
I.(1)恒压分液漏斗的特点是能保证液面上方和容器内压强相等,有利于漏斗内液体流下;
(2)减压蒸馏能降低液体的沸点,可防止馏份在高温下受热分解;
(3)此反应的特征是放热的可逆反应,可通过增加反应物的量或降温促进平衡正向移动,提高反应物的转化率;
Ⅱ.(4)①欲测定2-氯乙醇中氯元素的含量,可利用卤代烃的水解原理,使2-氯乙醇在氢氧化钠溶液中通过加热使之完全水解,再利用稀硝酸酸化中和多余的NaOH溶液,再滴加过量AgNO3溶液,使溶液中Cl-完全转化为AgCl沉淀,利用NH4SCN溶液滴定多余的Ag+,由此计算出滴定Cl-消耗的Ag+的量,从而计算出氯元素的含量;
②混合液中AgCl存在溶解平衡,滴加NH4SCN溶液,可能会促进平衡正向移动,生成AgSCN;
③NH4SCN溶液遇Fe3+的溶液显红色,则可利用含有Fe3+的溶液检验NH4SCN是否滴加过量;
(5)根据实验操作可知,溶液里Cl-的物质的量为AgNO3的总物质的量减去NH4SCN的物质的量,另外原样品中混合的HCl的物质的量可根据样品稀释后溶液的pH进行计算,从而计算出实际2-氯乙醇中氯元素的质量,并计算出氯元素的质量分数;
(6)欲检验2-氯乙醇是否与水反应生成氯化氢,可检验混合液中是否含有氯离子.
解答 解:(1)使用恒压分液漏斗可确保漏斗液面上方压强和烧瓶内气体压强相等,使漏斗内液体顺利流下,故答案为:平衡气压,使分液漏斗内的液体能顺利滴下;
(2)因为2-氯乙醇高温下易分解,可通过减压蒸馏的方法,降低其沸点,防分解,故答案为:减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解;
(3)可通过增大氯化氢的量或降温(控制反应温度控制在30℃)等方法促进平衡正向移动,提高环氧乙烷的利用率,故答案为:氯化氢过量;反应温度控制在30℃;
(4)①为样品中Cl元素含量的测定,可通过先取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;待完全水解后加稀硝酸至酸性;然后加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;再向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;最后加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;故答案为:cabde;
②防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,滴NH4SCN溶液前可加入硝基苯使沉淀表面被有机物覆盖,如果不进行此操作,则会有AgCl部分电离,消耗的NH4SCN溶液偏多,导致样品中氯元素的含量偏小,
故答案为:防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀;偏小;
③可利用溶液里Fe3+来检验NH4SCN溶液是否过量,现象是当溶液显血红色时可知滴定终点,故答案为:C;
(5)样品中含有HCl的物质的量为:0.1mol/L×0.01L=0.001mol;总AgNO3的物质的量为0.4mol/L×0.0325L=0.013mol;滴定消耗NH4SCN的物质的量为0.1mol/L×0.01L=0.001mol;则样品中氯原子的物质的量为:0.013mol-0.001mol-0.001mol=0.011mol;样品中氯元素的质量分数为:$\frac{0.011mol×80.5g/mol}{1mL×1.1g/mL}×100%$=80.5%,
故答案为:80.5%;
(6)欲证明2-氯乙醇与水反应生成氯化氢,可通过取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应,
故答案为:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.
点评 本题以制备2-氯乙醇并测定样品中氯元素的含量为载体,考查物质的制备实验与评价,涉及混合物的分离提纯、滴定原理、离子的检验等实验基本操作,属基础考查,难度适中,对学生的实验技能及分析问题、解决问题的能力要求较高.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中投入Na:Cu2++2Na═Cu+2Na+ | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 用氨水溶解Cu(OH)2:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl、NaOH、NH4NO3、CaCO3 | B. | FeCl3、CuSO4、Mg(OH)2、NaCl | ||
| C. | BaSO4、AgCl、KOH、NH4Cl | D. | NH4HCO3、MgCl2、BaCl2、Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com