
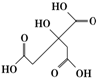
 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式为C6H7O7 | |
| B. | 1 mol物质X可以和4mol氢氧化钠发生反应 | |
| C. | X分子内所有原子均在同一平面内 | |
| D. | 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
分析 由结构可知分子式,X在含3个-COOH、1个-OH,结合羧酸、醇的性质来解答.
解答 解:A.根据结构简式可得分子式为C6H8O7,故A错误;
B.能与氢氧化钠反应的为羧基,1 mol物质X可以和3mol氢氧化钠发生反应,故B错误;
C.具有手性的碳原子和其他原子一定不能共面,故C错误;
D.-COOH与NaHCO3、Na2CO3反应,由C原子守恒可知,等物质的量的NaHCO3、Na2CO3反应得到的气体二氧化碳的物质的量相同,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重醇、羧酸等有机物性质的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
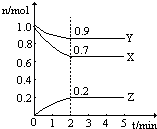 在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
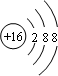 ,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为:
,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为: .AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.
.AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.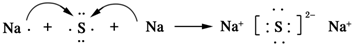 .该化合物属于离子(填“共价”或“离子”)化合物.
.该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜左侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mole-时,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应会改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学计量数:a+b>c | B. | 平衡向逆反应方向移动了 | ||
| C. | 物质B的转化率增加了 | D. | 物质B的物质的量增加了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )| A. | A分子属于酯类化合物,在一定条件下不能发生水解反应 | |
| B. | A在一定条件下可与4 mol H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物只有1种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com