
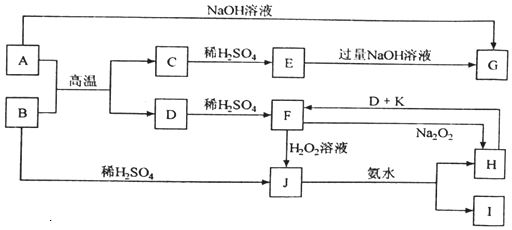
分析 B为红棕色粉末,则B为Fe2O3,B与硫酸反应生成J,J与氨水反应生成H和I,又J溶液滴入沸水中可得到以H为分散质的红褐色胶体,则J为Fe2(SO4)3,H为Fe(OH)3,I为(NH4)2SO4,金属D与稀硫酸反应生成F,F与过氧化钠反应生成H,则D为Fe,F为FeSO4,H与D、K反应生成F,所以K为稀硫酸;金属A与B的反应生成C与D,则C为金属氧化物,C系列转化得到G,而A能与氢氧化钠反应也得到G,故A为Al,C为Al2O3,E为Al2(SO4)3,G为NaAlO2,据此解答.
解答 解:(1)胶体中分散质的直径介于1~100nm,故答案为:1~100nm;
(2)根据以上分析,B的化学式为:Fe2O3,G的化学式为:NaAlO2,K的化学式为H2SO4,故答案为:Fe2O3;NaAlO2;H2SO4;
(3)F的酸性溶液与H2O2溶液反应的离子方程式:2H++2Fe2++H2O2=2Fe3++2H2O,故答案为:2H++2Fe2++H2O2=2Fe3++2H2O;
(4)I为(NH4)2SO4,则I中阳离子的实验方法和现象为:取少量I于试管中,用胶头滴管滴入NaOH溶液并加热试管,用湿润的红色石蕊试纸放试管口,如果变蓝则为铵根,故答案为:取少量I于试管中,用胶头滴管滴入NaOH溶液并加热试管,用湿润的红色石蕊试纸放试管口,如果变蓝则为铵根;
(5)向FeCl3的溶液中加入一定量金属Fe充分反应,发生反应:2Fe3++Fe=3Fe2+,Fe完全溶解:
①假设1:若FeCl3部分反应,溶液X一定含有FeCl2、未反应的FeCl3,则溶液X中含有的金属离子为:Fe2+、Fe3+,
假设2:若FeCl3与Fe恰好完全反应,溶液X只含有FeCl2,不含FeCl3,则溶液X中含有的金属离子为:Fe2+,
故答案为:Fe2+、Fe3+;Fe2+;
②取少许溶液X于试管中,滴加KSCN溶液.若观察到溶液变红色,则证明假设1成立;若无明显现象,则证明假设2成立,
故答案为:KSCN;溶液变红色;
(6)F为FeSO4,在F溶液中加入与F等物质的量的Na2O2,恰好使F转化为H,则该反应的离子方程式:6H2O+4Fe2++4Na2O2=8Na++O2↑+4Fe(OH)3↓;故答案为:6H2O+4Fe2++4Na2O2=8Na++O2↑+4Fe(OH)3↓.
点评 本题考查无机物推断、元素化合物的性质等,难度中等,B、H颜色为推断突破口,需要学生熟练元素化合物的性质,注意基础知识的积累掌握.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 发生腐蚀过程中,电子从接头流向水表 | |
| B. | 腐蚀时,铁接头发生的是还原反应 | |
| C. | 腐蚀时铜质水表发生的电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.98g | B. | 2.00g | C. | 2.22g | D. | 2.42g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(HCl)通过饱和Na2SO3溶液 | |
| B. | Na2CO3溶液(NaHCO3)滴加足量BaCl2溶液 | |
| C. | H2(H2S)通过CuSO4溶液 | |
| D. | Na2SO4溶液(Na2SO3)滴加足量HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有的水分子数为NA | |
| B. | 1mol Fe与足量的盐酸反应电子转移总数为3NA | |
| C. | 常温常压下,22g CO2中含有的氧原子数为NA | |
| D. | 500mL 1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
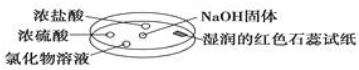 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与挥发出来的HCl气体反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 单质沸点:W>X>Z | |
| B. | 原子半径:Y>Z>W | |
| C. | Y的氧化物对应的水化物酸性一定比Z的弱 | |
| D. | W、X、Z三种元素组成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m-1.6)g | B. | (m-2.4)g | C. | (m-3.2)g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe3+、SO42-、NO3- | B. | Na+、K+、NH4+、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | K+、Na+、ClO-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com